题目内容
16.水资源的利用、开发、保护直接关系到人类的生存和国民经济的发展.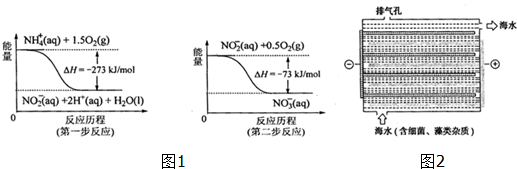
Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
分析 I.(1)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273kJ•mol-1,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1,利用盖斯定律可计算1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式;
(2)用H2催化还原法也可降低饮用水中NO3-的浓度,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气;
(3)只有NH4+水解显酸性,结合电荷守恒计算c(H+),可知pH;
Ⅱ.(1)明矾中含有铝离子,铝离子在水中水解生成氢氧化铝胶体,胶体具有吸附性而净水;
(2)①电解饱和氯化钠溶液反应生成氢氧化钠、氯气和氢气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
②阴极生成氢气,水的电离被破坏电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀;
③阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,酸溶解沉淀.
解答 解:I.(1)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273kJ•mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1;
(2)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-,
故答案为:5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-;
(3)只有NH4+水解显酸性,由电荷守恒可知,c(H+)=(3×10-5)×2+(5×10-5)+(2×10-5)-(3×10-6+7×10-6+2×10-5)=1×10-4,则pH=4,故答案为:4;
Ⅱ.(1)明矾中含有铝离子,铝离子在水中水解生成氢氧化铝胶体,胶体具有吸附性而净水,水解方程式为Al3++3H2O?Al(OH)3(胶体)+3H+;
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(2)①装置中由NaCl转化为NaClO的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O;
②阴极生成氢气,电极附近水的电离被破坏,电极附近生成氢氧化钠,氢氧化钠和碳酸氢钙,碳酸氢镁反应生成氢氧化镁、碳酸钙沉淀,氢氧化钠和碳酸氢钙反应生成CaCO3的沉淀产生水垢,生成碳酸钙沉淀的反应离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
③由电解原理可知,阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的,
故答案为:阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
点评 本题考查较综合,涉及海水资源的利用、电解原理、反应热计算、盐类水解等,综合性较强,注重高频考点的考查,把握反应原理为解答的关键,题目难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案Ⅰ.用Ⅰ1、Ⅰ2、Ⅰ3、Ⅰ4表示钪的电离能,其数据如图1.
(1)与钪同周期且含有相同未成对电子数的非金属元素为Br(填元素符号).
(2)$\frac{{I}_{2}}{{I}_{1}}$<$\frac{{I}_{4}}{{I}_{3}}$(填“>”或“<”).
(3)氯化钠晶体熔点高于氯化钾,其原因为钠离子半径小于钾离子,氯化钠晶格能大于氯化钾,所以氯化钠熔点高.
Ⅱ.提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为2种.
(6)Sc2(C2O4)3•6H2O从583K加热到873K,断裂的化学键类型为离子键、共价键.
| A. | 原子半径:W>Z>Y>X | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最外层电子数:Y>W | D. | Y、z的氧化物都是两性氧化物 |
| A. | Al2(SO4)3可除去酸性废水中的悬浮颗粒 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | 煤通过气化、液化和干馏等可获得清洁能源和重要的化工原料 | |
| D. | 高锰酸钾溶液和双氧水进行环境消毒时原理相同 |
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |

 ;
;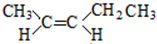 、和
、和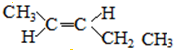 ;
; .
. .请回答:
.请回答: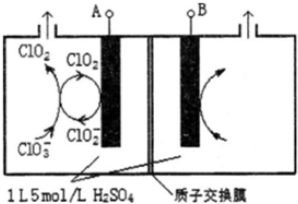 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.