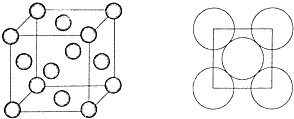
题目内容
11.pH=1的某溶液X中仅含有NH
4+、Al
3+、Ba
2+、Fe
2+、Fe
3+、CO
32-、SO
32-、SO
42-、Cl
-、NO
3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:下列有关推断不正确的是( )

| A. | 沉淀H为Al(OH)3、BaCO3的混合物 |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
分析 pH=1的溶液为强酸性溶液,在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,那么一定含有SO42-离子,那么就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答即可.
解答 解:pH=1的溶液为强酸性溶液,在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,则A只能是NO,说明溶液中含有还原性离子,则一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀F只为Fe(OH)3,生成气体D,则D为NH3,说明溶液中含有NH4+离子;溶液E中通入CO2气体,生成沉淀H,则H为Al(OH)3,E为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子和SO32-离子,那么一定含有SO42-离子,那么就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
A、根据上述分析可知H为Al(OH)3,BaCO3与过量的二氧化碳生成碳酸氢钡,易溶于水,故A错误;
B、根据上述连续实验不能确定溶液X中是否含有Fe3+和Cl-,故B正确;
C、依据分析可知,溶液中一定存在:NH4+、Al3+、Fe2+、SO42-和H+,故C正确;
D、生成气体A的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的气体A为44.8 mL,物质的量为:0.0448L22.4L/mol=0.002mol,故n(Fe2+)=3×0.002=0.006mol,c(Fe2+)=0.006mol0.1L=0.06mol/L,故D正确,
故选A.
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.
练习册系列答案
相关题目


 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
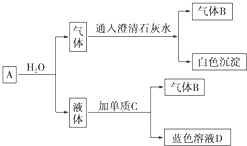
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( ) 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验. 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. .
.