题目内容
16.将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化.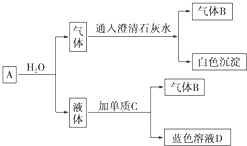
A是CO2、NO2,B是NO,C是Cu,D是Cu(NO3)2(填化学式).
分析 红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,可考虑为碳与浓硝酸的反应,蓝色溶液D应含有铜离子,气体通入澄清石灰水有白色沉淀,应为碳酸钙沉淀,根据元素守恒及反应特征进行物质推断.
解答 解:红热的固体单质M放入浓硝酸中,剧烈反应,应发生氧化还原反应,产生混合气体A,则该反应应为碳与浓硝酸的反应,则A中应有CO2、NO2,A与水反应生成的液体为硝酸,单质C和A与水反应后的液体反应生成蓝色溶液D,则该蓝色溶液中含有铜离子,则单质C为Cu,D为Cu(NO3)2,铜和稀硝酸在常温下反应,生成气体B是NO,A与水反应生成的气体为NO和CO2,该气体通入澄清石灰水得白色沉淀为CaCO3,气体B是NO,综上所述,A为CO2、NO2,B为NO,C为Cu,D为Cu(NO3)2,
故答案为:CO2、NO2;NO;Cu;Cu(NO3)2;
点评 本题以氮的化合物为载体考查了物质的推断,题目难度中等,根据蓝色溶液为突破口采用正逆结合的方法进行推断,注意结合物质的颜色、性质来分析解答,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
4.常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| B. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
11.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:下列有关推断不正确的是( )


| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
1.为了除去硫酸铜溶液中含有的Fe2+杂质,先加入合适的氧化剂使Fe2+氧化为Fe3+,下列物质中最好选用( )
| A. | KMnO4溶液 | B. | H2O2溶液 | C. | 氯水 | D. | HNO3溶液 |

 B
B 或
或 C
C E
E
 .
.