题目内容
19.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列说法正确的是( )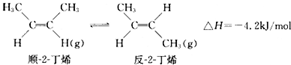
| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
分析 A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.加压平衡向物质的量减小的方向移动;
D.反-2-丁烯含碳碳双键.
解答 解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A错误;
B.等量的顺-2-丁烯具有更高的能量,所以顺-2-丁烯燃烧热更大,故B正确;
C.该反应反应前后物质的量相等,加压对顺、反2-丁烯的转化无影响,降温则是有利反-2-丁烯的生成,故C错误;
D.反-2-丁烯含碳碳双键,能使溴水褪色,故D错误.
故选B.
点评 本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.

练习册系列答案
相关题目
9.Murad等三位教授最早提出NO分子在人体内独特功能.近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学奖及生理学奖.下列关于NO的叙述不正确的是( )
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
10.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
4.常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| B. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
11.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:下列有关推断不正确的是( )


| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |

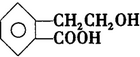 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.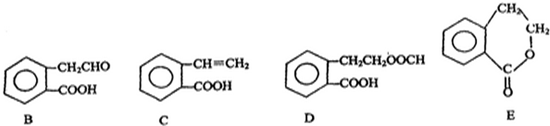
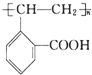 .
. +H2O.
+H2O.