题目内容
1.短周期主族元素X、Y、Z在周期表中的位置如图.下列说法正确的是( )| Z | |
| X | Y |
| A. | Z元素的最高化合价一定大于X元素 | |
| B. | 三种元素原子半径由高到低的顺序一定是Y>X>Z | |
| C. | 若它们的原子最外层电子数之和为11,则X为金属元素 | |
| D. | 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 |
分析 由短周期元素在周期表中的位置可知,Z处于第二周期,X、Y处于第三周期,
A.若Z处于ⅥA族或ⅦA族时,Z元素一般没有最高正化合价;
B.同周期元素从左到右原子半径逐渐减小;
C.若它们的原子最外层电子数之和为11,令X最外层电子数为a,Y、Z最外层电子数为a+1,则a+a+1+a+1=11,解得a=3,故X为Al、Y为Si、Z为C;
D.若它们均为金属元素,则X为Na、Y为Mg、Z为Be.
解答 解:由短周期元素在周期表中的位置可知,Z处于第二周期,X、Y处于第三周期,
A.若Z处于ⅥA族或ⅦA族时,为O或F元素,最高正化合价,故A错误;
B.同周期元素从左到右原子半径逐渐减小,应为X>Y,故B错误;
C.若它们的原子最外层电子数之和为11,令X最外层电子数为a,Y、Z最外层电子数为a+1,则a+a+1+a+1=11,解得a=3,故X为Al、Y为Si、Z为C,故C正确;
D.若它们均为金属元素,则X为Na、Y为Mg、Z为Be,X的最高价氧化物对应水化物的碱性最强,故D错误.
故选C.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,注意掌握周期表中的特殊性,利用列举法解答,注意对元素周期表的整体把握,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
11.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:下列有关推断不正确的是( )


| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
16.每种物质都既有离子键,又有共价键的一组物质是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
10.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
11.某反应的反应过程中能量变化如图所示.下列有关叙述正确的是( )
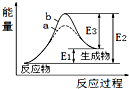

| A. | 该反应为放热反应 | |
| B. | b表示的有催化剂 | |
| C. | 催化剂能降低正、逆反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
 B
B 或
或 C
C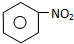 E
E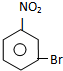
 .
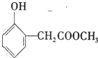
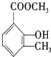
.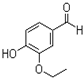 乙基香兰素是一种合成香料,其结构简式如图:
乙基香兰素是一种合成香料,其结构简式如图: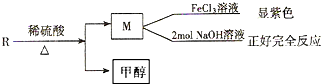
 、
、 ;
;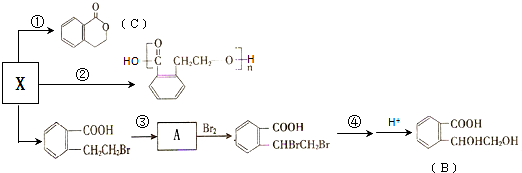
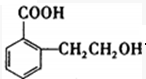 ;B中含氧官能团的名称羟基、羧基;
;B中含氧官能团的名称羟基、羧基; .
.