题目内容
6.下列实验操作、现象和结论均正确的是( )| 选项 | 操作 | 现象 | 结论 |
| A | KIO3溶液中滴加HI,再滴加淀粉溶液 | 溶液出现蓝色 | KIO3氧化性比I2强 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 将一小块Na放入乙醇中 | 产生气泡 | 乙醇含有羟基 |
| D | 沿杯壁向水中加浓H2SO4,搅拌 | 烧杯外壁发烫 | 浓硫酸溶于水放热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KIO3溶液中滴加HI,再滴加淀粉溶液,溶液出现蓝色,说明生成碘;
B.比较非金属性,应根据最高价氧化物对应的水化物的酸性判断;
C.不能排出C-H的影响,应从量的角度判断;
D.烧杯外壁发烫,可说明溶解放热.
解答 解:A.KIO3溶液中滴加HI,再滴加淀粉溶液,溶液出现蓝色,说明生成碘,由氧化剂氧化性大于氧化产物的氧化性可知KIO3氧化性比I2强,故A正确;
B.比较非金属性,应根据最高价氧化物对应的水化物的酸性,可根据硫酸、高氯酸或氢化物的稳定性判断,故B错误;
C.不能排出C-H的影响,应从量的角度判断,故C错误;
D.沿杯壁向水中加浓H2SO4,搅拌,烧杯外壁发烫,可说明浓硫酸溶于水放热,故D正确.
故选AD.
点评 本题考查较为综合,涉及物质的性质的比较、检验等,为高频考点,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.用10mL 0.1mol/L BaCl2溶液恰好可分别使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的SO42-完全转化为硫酸钡沉淀,则这三种硫酸盐的物质的量浓度之比为( )
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
11.pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:下列有关推断不正确的是( )


| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
18.电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4.下列判断错误的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 原子半径:X>Y>Z | ||
| C. | 非金属性:X>Y>Z | D. | 单质氧化性:X>Y>Z |
16.每种物质都既有离子键,又有共价键的一组物质是( )
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | MgO、Na2SO4、NH4HCO3 | ||
| C. | Na2O2、NH4Cl、Na2SO4 | D. | HCl、Al2O3、MgCl2 |
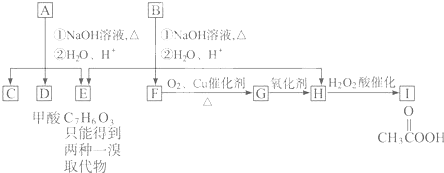
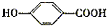
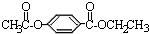 A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
 .
. 或
或 .
.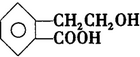 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.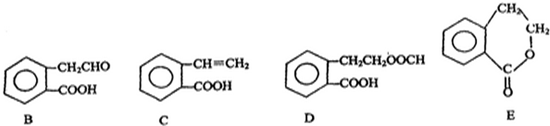
 .
. +H2O.
+H2O.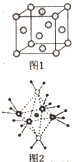 X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.
X、Y、Z、R、M、Q为前四周期元素,且原子序数依次增大,YZ2是红棕色气体;X与Y元素可形成YX3;R+与Z2-具有相同的核外电子排布;M-的M层电子数是K层上电子的4倍;Q2+离子的3d轨道中有9个电子.