题目内容
2.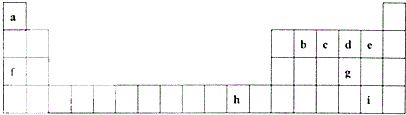 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题;
(1)d位于p区,其基态原子核外电子排布图为
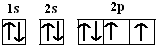 .
.(2)直线分子b2a2中σ键与π键的数目之比为3:2.
(3)b、c、d形成的双核粒子中,互为等电子体的有CO、N2、CN-、C22-(填粒子符号,任写一对),c第一电离能大于d的原因是N原子的最外层P轨道处于半满状态,是一种稳定结构,失去一个电子所需能量更多.
(4)在相同条件下,bd2与gd2在水中溶解度较大的是SO2(填化学式);gd2原子的杂化方式为sp2,该分子的VSPR模型名称为平面三角形.
(5)f分别与e、i形成的简单化合物中,熔点较高的是NaF(填化学式),理由是NaF的晶格能大于NaCl.
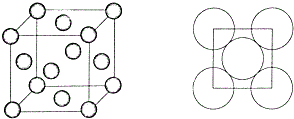
(6)h的晶胞结构图及二维平面晶体示意图如下,其中h原子半径为r,列式表示h原子在晶胞的空间利用率$\frac{\sqrt{2}π}{6}$(不要求计算结果).
分析 根据元素在周期表中位置可知,a为H,b为C,c为N,d为O,e为F,f为Na,g为S,h为Cu,i为Br,
(1)氧元素位P区,是8号元素,据此画电子排布图;
(2)C2H2中C、H之间有一个单键,C、C之间为参键,其中一个是σ键,两个是π键;
(3)b、c、d形成的双核粒子为CO、NO、N2、O2、CN-、C22-,等电子体为价电子数和原子数都相等的微粒,据此判断,N原子的最外层P轨道处于半满状态,是一种稳定结构;
(4)二气化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理判断溶解性,根据二氧化硫中硫原子的价层电子对数判断硫原子的杂化方式及分子的VSPR模型;
(5)根据晶格能大小可以判断NaCl和NaF的熔点高低;
(6)根据空间利用率=$\frac{晶胞中所含原子总体积}{晶胞体积}$×100%进行计算.
解答 解:根据元素在周期表中位置可知,a为H,b为C,c为N,d为O,e为F,f为Na,g为S,h为Cu,i为Br,
(1)氧元素位P区,是8号元素,电子排布图为 ,故答案为:p;
,故答案为:p; ;
;
(2)C2H2中C、H之间有一个单键,C、C之间为参键,其中一个是σ键,两个是π键,所以C2H2中σ键与π键的数目之比为3:2,
故答案为:3:2;
(3)等电子体为价电子数和原子数都相等的微粒,b、c、d形成的双核粒子为CO、NO、N2、O2、CN-、C22-,其中互为等电子体的是CO、N2、CN-、C22-,N原子的最外层P轨道处于半满状态,是一种稳定结构,失去一个电子所需能量更多,所以N第一电离能大于O,
故答案为:CO、N2、CN-、C22-;N原子的最外层P轨道处于半满状态,是一种稳定结构,失去一个电子所需能量更多;
(4)二气化碳是非极性分子,二氧化硫是极性分子,水为极性分子,所以二氧化硫在水中的溶解性更大,二氧化硫分子中硫原子的价层电子对数为$\frac{6+0}{2}$=3,所以硫原子的杂化方式为sp2,分子的VSPR模型为平面三角形,
故答案为:SO2;sp2;平面三角形;
(5)由于NaF的晶格能大于NaCl,所以NaF的熔点高于NaCl,故答案为:NaF;NaF的晶格能大于NaCl;
(6)铜的晶胞中含有铜原子数为8×$\frac{1}{8}$$+6×\frac{1}{2}$=4,其中铜原子半径为r,则铜原子体积为$\frac{4}{3}π{r}^{3}$,根据晶胞的结构图,晶胞的面对角线的长度为4r,所以晶胞的边长为$2\sqrt{2}$r,所以晶胞的体积为($2\sqrt{2}r$)3,所以铜晶胞中原子空间利用率=$\frac{晶胞中所含原子总体积}{晶胞体积}$×100%=$\frac{4×\frac{4}{3}π{r}^{3}}{({2\sqrt{2}r)}^{3}}$×100%=$\frac{\sqrt{2}π}{6}$,
故答案为:$\frac{\sqrt{2}π}{6}$.
点评 本题是对物质结构的考查,涉及元素周期表、等电子体、电离能、杂化轨道、核外电子排布、晶胞计算、晶体的性质等,比较全面考查物质结构主干知识,需要学生具备扎实的基础,晶胞计算为易错点,注意掌握同周期中第一电离能异常原因,难度较大.

(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).
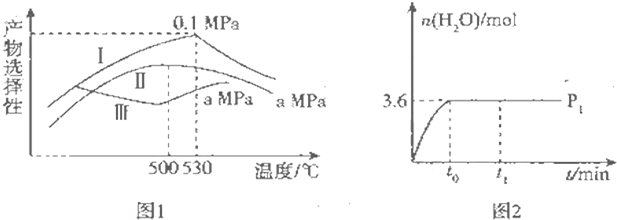
①为尽可能多地获得乙烯,控制的生产条件为530℃、0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)在压强为P1 时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图.
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
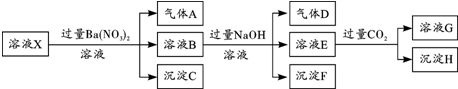
| A. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| B. | 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol•L-1 |
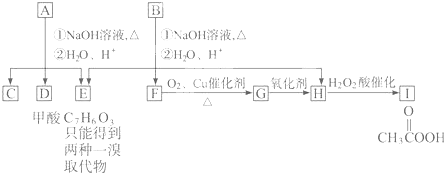
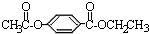 A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.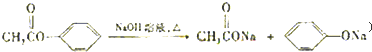
 .
.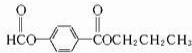 或
或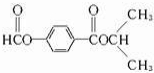 .
.
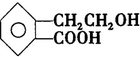 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.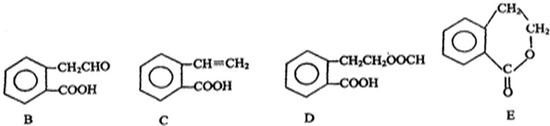
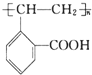 .
.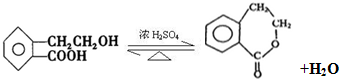 +H2O.
+H2O.