题目内容
10.A、B均为无色盐溶液,B的焰色反应呈黄色,E和F均为有刺激性气味的气体,H不溶于酸,一定条件下A、B可以发生图所示的物质之间的一系列变化:请填写下列空白.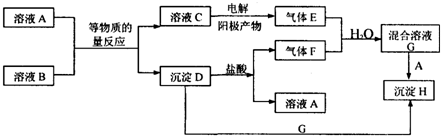
(1)气体F的化学式为SO2,C中溶质的化学式为NaCl.
(2)写出下列反应的离子方程式:C→E2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-; D+G→HBaSO3+2H++SO42-=BaSO4↓+SO2↑+H2O;
(3)在混合溶液G中若滴入几滴石蕊溶液,可见现象为变红色,原因是SO2+Cl2+2H2O=2HCl+H2SO4( 用化学方程式表示G溶液的形成过程)
分析 A、B均为无色盐溶液,B的焰色反应呈黄色,判断B中含有钠元素,若E和F均为有刺激性气味的气体,E是电解溶液C得到的,分析判断C为含钠的化合物,H不溶于酸,沉淀D和G反应实现沉淀转化,推断H为硫酸钡沉淀,D为亚硫酸钡沉淀,E为黄绿色气体Cl2,F为无色刺激性气味的气体,并且能与E反应,应为SO2,则G应为硫酸和盐酸的混合物,H为BaSO4,A为BaCl2,D为BaSO3,B为Na2SO3,C为NaCl,结合对应物质的性质以及题目的要求可解答该题.
解答 解:A、B均为无色盐溶液,B的焰色反应呈黄色,判断B中含有钠元素,若E和F均为有刺激性气味的气体,E是电解溶液C得到的,分析判断C为含钠的化合物,H不溶于酸,沉淀D和G反应实现沉淀转化,推断H为硫酸钡沉淀,D为亚硫酸钡沉淀,E为黄绿色气体Cl2,F为无色刺激性气味的气体,并且能与E反应,应为SO2,则G应为硫酸和盐酸的混合物,H为BaSO4,A为BaCl2,D为BaSO3,B为Na2SO3,C为NaCl,
(1)由以上分析可知F为SO2,C为NaCl,故答案为:SO2;NaCl;
(2)C→E的反应为电解饱和食盐水的反应,方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,D+G→H的反应为亚硫酸钡和混酸的反应,
反应的离子方程式为BaSO3+2H++SO42-=BaSO4↓+SO2↑+H2O,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;BaSO3+2H++SO42-=BaSO4↓+SO2↑+H2O;
(3)A为BaCl2,B为Na2SO3,因A与B是等物质的量混合发生反应Na2SO3+BaCl2=2NaCl+BaSO3↓,所以电解NaCl饱和溶液得到的Cl2和BaSO3与H2SO4反应生成的SO2亦为等物质的量,即Cl2与SO2恰好完全反应:SO2+Cl2+2H2O=2HCl+H2SO4,最终得到C溶液只有酸性而无漂白性,当二者等物质的量反应时生成盐酸和硫酸,溶液呈酸性,滴入几滴石蕊溶液,溶液变红,
故答案为:变红色;SO2+Cl2+2H2O=2HCl+H2SO4.
点评 本题考查无机物的推断,本题注意以E、F的气味,沉淀特征和元素反应为推断该题的突破口,熟练掌握相关元素混合物的性质为解答该题的关键,该题很好地考查学生的思维、推断、分析能力,题目难度中等.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 同温度同物质的量浓度时,HF比HCN酸性强,则同浓度的NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.1mol•L-1的NH4Cl溶液与0.1mol•L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(NH4+ )>c(OH-)>c(H+) | |
| C. | 相同物质的量浓度的下列溶液中,①NH4Al(SO2)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;其中c(NH${\;}_{4}^{+}$) 由大到小的顺序是:①>②>③>④ | |
| D. | PH=11的Na2CO3溶液中:c(Na+)-2c(CO${\;}_{3}^{2-}$)-c(HCO${\;}_{3}^{-}$)=10-3-10-11 |
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |

 、
、 、
、 、
、 、
、 .
.
 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.