��Ŀ����
20��ͼ1�Dz��ֶ�����Ԫ�صij������ϼ���ԭ�������Ĺ�ϵͼ��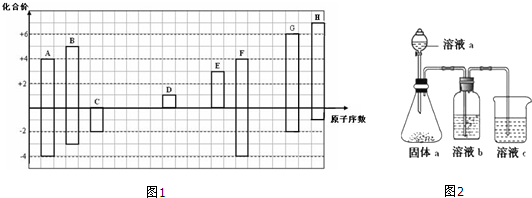
��1��Ԫ��F�����ڱ��е�λ�õ������ڢ�A�壮
��2���õ���ʽ��ʾDH���γɹ���
 ����������ѧ������Ϊ���Ӽ���
����������ѧ������Ϊ���Ӽ�����3��C��D��G��Ӧ�ļ����Ӱ뾶��С˳����S2-��O2-��Na+��
�������ӷ��Żش�
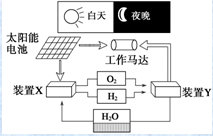
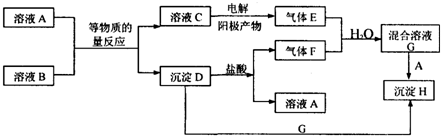
��4��ijͬѧ���ʵ��װ����ͼ2��֤��A��B��F�ķǽ�����ǿ����ϵ��
����Һa����Һb�ֱ�Ϊ���ᣬ����NaHCO3��Һ��
����Һc�е����ӷ�Ӧ����ʽΪSiO32-+CO2+H2O=H2SiO3��+CO32-��SiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��
�����ԭ�ӽṹ�ĽǶȽ��ͷǽ�����B��A��ԭ��̼ͬһ���ڣ�����ԭ�ӵĺ˵������ԭ�Ӱ뾶С����ԭ�Ӻ˶��������ӵ����������õ���������ǿ
��5����1mol D2C2Ͷ��200mL 3mol/L EH3��Һ�У�
��ת�Ƶ��ӵ����ʵ���Ϊ1mol��
����һ����ѧ��Ӧ����ʽ��ʾ�÷�Ӧ10Na2O2+6AlCl3+6H2O=4Al��OH��3��+2NaAlO2+5O2��+18NaCl��
���� ����ͼ1֪��A��F����ϼ۶���4���������ڵ�IVA��Ԫ�أ���ԭ������F��A����A��CԪ�ء�F��SiԪ�أ�
B�����������+5�ۣ���ԭ����������A��С��F��ΪNԪ�أ�
Cֻ��-2�ۣ�ΪOԪ�أ�
D���������+1�ۣ���ԭ����������C������ΪNaԪ�أ�
EԪ����������ϼ���+3�ۣ���ԭ����������D����E��AlԪ�أ�
GԪ�����������+6�ۣ�ΪSԪ�أ�
H���������+7�ۣ����Ƕ�����Ԫ�أ�������ClԪ�أ�
��1��F��PԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȡ�����������������������ȣ�
��2��NaCl�����ӻ���������Ӻ�������֮��������Ӽ���
��3�����ӵ��Ӳ���Խ�࣬�����Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С��
��4����װ��ͼ��֪��ʵ��ԭ��������ǿ���Ʊ����ᣬ�����ӷ���Ϊ��ֹ����Ӧ��ȥ������ƿ�в���������̼��ӦΪ������̼���η�Ӧ����Һb���ջӷ������ᣬӦΪ���͵�̼�����ƣ��ձ���Ӧ�Ƕ�����̼������Ʒ�Ӧ���ɹ��
��5���ٷ�Ӧ�й�������������������ԭ�����ã���ռһ�룬���OԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
�ڽ�1mol Na2O2Ͷ��200mL 3mol/L AlCl3��Һ�У�����NaOH 2mol��0.5mol������AlCl3�ܵ����ʵ���Ϊ0.6mol��1��4��n��AlCl3����n��NaOH��=3��10��1��3��������Al��OH��3��AlO2-����Һ������Ϊƫ�����ơ��Ȼ��ƣ����ݵ���غ��֪��Ӧ��n��AlO2-��=2mol-0.6mol��3=0.2mol������AlԪ���غ��֪��n[Al��OH��3]=0.6mol-0.2mol=0.4mol��ȷ��n[Al��OH��3]��n��AlO2-����n������������ƽ��д��
��� �⣺����ͼ1֪��A��F����ϼ۶���4���������ڵ�IVA��Ԫ�أ���ԭ������F��A����A��CԪ�ء�F��SiԪ�أ�
B�����������+5�ۣ���ԭ����������A��С��F��ΪNԪ�أ�
Cֻ��-2�ۣ�ΪOԪ�أ�
D���������+1�ۣ���ԭ����������C������ΪNaԪ�أ�
EԪ����������ϼ���+3�ۣ���ԭ����������D����E��AlԪ�أ�
GԪ�����������+6�ۣ�ΪSԪ�أ�
H���������+7�ۣ����Ƕ�����Ԫ�أ�������ClԪ�أ�
��1��F��PԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȡ�����������������������ȣ�PԪ��ԭ�Ӻ�����3�����Ӳ㡢������������5������λ�ڵ������ڢ�A�壬�ʴ�Ϊ���������ڢ�A�壻
��2��NaCl�����ӻ���������Ӻ�������֮��������Ӽ������γɹ���Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� �����Ӽ���
�����Ӽ���
��3�����ӵ��Ӳ���Խ�࣬�����Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�����Ӱ뾶��С˳����S2-��O2-��Na+���ʴ�Ϊ��S2-��O2-��Na+��
��װ��ͼ��֪��ʵ��ԭ��������ǿ���Ʊ����ᣬ�����ӷ���Ϊ��ֹ����Ӧ��ȥ������ƿ�в���������̼��ӦΪ������̼���η�Ӧ����Һb���ջӷ������ᣬӦΪ���͵�̼�����ƣ��ձ���Ӧ�Ƕ�����̼������Ʒ�Ӧ���ɹ��ᣬ
��������������֪����ҺaΪ���ᣬ��ҺbΪ����NaHCO3��Һ���ʴ�Ϊ���������NaHCO3��Һ��
����Һc�е����ӷ���ʽΪ��SiO32-+CO2+H2O=H2SiO3��+CO32- ��SiO32-+2CO2+2H2O=H2SiO3��+2HCO3-
�ʴ�Ϊ��SiO32-+CO2+H2O=H2SiO3��+CO32- ��SiO32-+2CO2+2H2O=H2SiO3��+2HCO3-��
��̼�͵�Ԫ�ش���ͬһ���ڣ���ԭ�ӵĺ˵��������̼ԭ�ӣ�ԭ�Ӱ뾶��̼ԭ��С����ԭ�Ӻ˶��������ӵ����������õ���������ǿ����˵�Ԫ�صķǽ�����ǿ��̼Ԫ�أ�
�ʴ�Ϊ��̼�͵�Ԫ�ش���ͬһ���ڣ���ԭ�ӵĺ˵��������̼ԭ�ӣ�ԭ�Ӱ뾶��̼ԭ��С����ԭ�Ӻ˶��������ӵ����������õ���������ǿ��
��5����Na2O2ͶAlCl3��Һ�У�����ˮ����������������������Ӧ�й�������������������ԭ�����ã���ռһ�룬��ԭ���Ĺ���������OԪ�ػ��ϼ���-1����Ϊ0�ۣ���0.5molNa2O2����ת�Ƶ���Ϊ1mol��$\frac{1}{2}$��2��[0-��-1��]=1mol��
�ʴ�Ϊ��1mol��
�ڽ�1mol Na2O2Ͷ��200mL 3mol/L AlCl3��Һ�У�����NaOH 2mol��0.5mol������AlCl3�ܵ����ʵ���Ϊ0.6mol��1��4��n��AlCl3����n��NaOH��=3��10��1��3��������Al��OH��3��AlO2-����Һ������Ϊƫ�����ơ��Ȼ��ƣ����ݵ���غ��֪��Ӧ��n��AlO2-��=2mol-0.6mol��3=0.2mol������AlԪ���غ��֪��n[Al��OH��3]=0.6mol-0.2mol=0.4mol��ȷ��n[Al��OH��3]��n��AlO2-����n����������
n[Al��OH��3]��n��AlO2-����n��������=0.4mol��0.2mol��0.5mol=4��2��5��
��ѧ��Ӧ����ʽΪ��10Na2O2+6AlCl3+6H2O=4Al��OH��3��+2NaAlO2+5O2��+18NaCl��
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɵ��ۺ�Ӧ�á���ѧ����ʽ�ļ��㡢����ʵ�鷽����Ƶ�֪ʶ�㣬�ۺ��Խ�ǿ���ѵ�������ʵ�鷽����ƺͻ�ѧ����ʽ�ļ��㣬ע�⣨5���ⷢ���ķ�Ӧ������������֮��Ĺ�ϵ����Ŀ�Ѷ��еȣ�

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д���CH2OH��CHOH��4CHO
��CH3��CH2��3OH
��CH2�TCH-CH2OH
��CH2�TCH-COOCH3
��CH2�TCH-COOH��
���м��ܷ����ӳɷ�Ӧ���Ӿ۷�Ӧ��������Ӧ�����ܷ���������Ӧ���ǣ�������
| A�� | �ۢ� | B�� | �٢ڢ� | C�� | �ڢ� | D�� | �ۢ� |
| A�� | ����������ı��˷�Ӧ��;������Ӧ�ġ�HҲ��֮�ı� | |
| B�� | ��Ӧ��������С�������������� | |
| C�� | �����¶ȣ���Ӧ���ʼӿ죬����Ӧ�ġ�H���� | |
| D�� | ����ԭ����н��У���Ӧ�ų����������� |
| A�� | װ��X��ʵ��ȼ�ϵ�ص�ȼ�Ϻ����������� | |
| B�� | װ��Y�и����ĵ缫��ӦʽΪO2+2H2O+4e-�T4OH- | |
| C�� | ��ϵͳ��ֻ����3����ʽ������ת�� | |
| D�� | װ��X��Y�γɵ���ϵͳ��ʵ���������ŷţ�����ʵ�ֻ�ѧ������ܼ����ȫת�� |
| A�� | 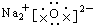 | B�� | 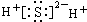 | ||
| C�� | 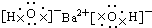 | D�� |  |
| A�� | ��ͼ��ʾ�ķ�ӦΪ���ȷ�Ӧ | |
| B�� | ��ѧ��Ӧ�������ʱ仯Ҳ�������仯 | |
| C�� | ��Ҫ���Ȳ��з����ķ�Ӧһ�������ȷ�Ӧ | |
| D�� | ��ѧ������������������ѧ�����ɷų����� |
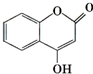 �������Ʊ�����Ѫҩ��ͨ������·�ߺϳɣ�
�������Ʊ�����Ѫҩ��ͨ������·�ߺϳɣ�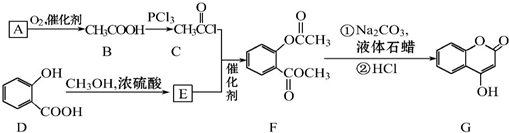
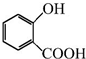 +CH3OH$?_{��}^{Ũ����}$
+CH3OH$?_{��}^{Ũ����}$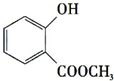 +H2O��
+H2O�� +3NaOH$\stackrel{��}{��}$
+3NaOH$\stackrel{��}{��}$ +CH3COONa+CH3OH+H2O��
+CH3COONa+CH3OH+H2O��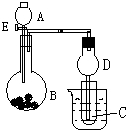 ����ͼ��ʾװ�ý���ʵ�飬��A��μ���B�У�
����ͼ��ʾװ�ý���ʵ�飬��A��μ���B�У�