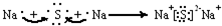题目内容
1.硫化钠主要用于皮革、毛纺、高档纸张、染料等行业.生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如图1:
(1)若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑.
(2)上述流程中采用稀碱液比用热水更好,理由是热水会促进Na2S水解,而稀碱液能抑制Na2S水解.
(3)常温下,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,则此时溶液中c( S2-)=4.0×10-36mol/Lmol•L-1.(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用
量的比值)有关(如图1所示).为使除汞效果最佳,应控制的条件是:x=12,pH控制在9~10之间范围.
②某毛纺厂废水中含0.001mol•L-1的硫化钠,与纸张漂白后的废水(含0.002mol•L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有SO42-、Cl-.
(5)常温下利用Fe2+、Fe3+的相互转化,可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 根据图1可知,制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡抑制硫离子水解,通过精制获得硫化钠晶体,
(1)Na2SO4与碳在高温煅烧,再碱浸、精制得到Na2S,说明反应有Na2S生成,且产生等物质的量的CO和CO2,配平书写方程式;
(2)硫化钠溶液中硫离子水解显碱性,根据水解平衡影响因素分析判断;
(3)溶液中c(OH-)=10-10mol/L,代入Ksp[Cu(OH)2]计算溶液中c(Cu2+),再将c(Cu2+)代入Ksp(CuS)计算溶液中c( S2-);
(4)①硫化钠的实际用量与理论用量的比值越小,消耗硫化钠少,且汞去除率最高,据此结合图象判断;
②次氯酸钠和硫化钠发生氧化还原反应,次氯酸根被还原为Cl-,根据电子转移守恒计算S元素在氧化产物中的化合价,确定氧化产物;
(5)Fe3+离子具有强氧化性,在溶液中可以将SO2氧化为SO42-,自身被还原为Fe2+,配平书写离子方程式.
解答 解:根据图1可知,制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡抑制硫离子水解,通过精制获得硫化钠晶体,
(1)Na2SO4与碳在高温煅烧,再碱浸、精制得到Na2S,说明反应有Na2S生成,且产生等物质的量的CO和CO2,配平后的化学方程式为:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,
故答案为:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(2)硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用,上述流程中采用稀碱液比用热水更好,
故答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(3)反应后测得溶液的pH=4,则溶液中c(OH-)=10-10mol/L,根据Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,可得c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2mol/L,由Ksp=c(Cu2+)c(S2-)=8.8×10-36,可得此时溶液中c( S2-)=$\frac{8.8×1{0}^{-36}}{2.2}$mol/L=4.0×10-36mol/L,
故答案为:4.0×10-36mol/L;
(4)①由图可知,x=12~16,pH介于9~10之间时汞的去除率最大,接近100%,硫化钠的实际用量与理论用量的比值越小,消耗硫化钠少,故选择x=12、pH介于9~10之间
故答案为:12; 9~10之间;
②次氯酸钠和硫化钠发生氧化还原反应,次氯酸根被还原为Cl-,设S元素在氧化产物中化合价为a,根据电子转移守恒,则0.001mol/L×1L×[a-(-2)]=0.002mol•L-1×2L,解得a=6,故氧化得到SO42-,处理后的废水中所含的主要阴离子有SO42-、Cl-,
故答案为:SO42-、Cl-;
(5)Fe3+离子具有强氧化性,在溶液中可以将SO2氧化为SO42-,自身被还原为Fe2+,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题是实验制备方案、溶度积有关计算、沉淀转化、氧化还原反应计算、离子方程式书写等,实验拼合型题目,是对基础知识的综合应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案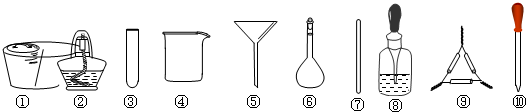
| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
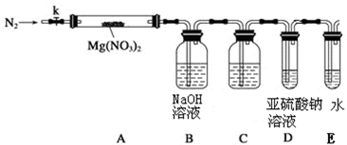 某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.
某学习小组以Mg(NO3)2为研究对象,拟通过实验初步探究硝酸盐热分解的规律.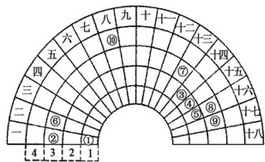 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题