题目内容
1.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )| A. | 同温度同物质的量浓度时,HF比HCN酸性强,则同浓度的NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.1mol•L-1的NH4Cl溶液与0.1mol•L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(NH4+ )>c(OH-)>c(H+) | |
| C. | 相同物质的量浓度的下列溶液中,①NH4Al(SO2)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;其中c(NH${\;}_{4}^{+}$) 由大到小的顺序是:①>②>③>④ | |
| D. | PH=11的Na2CO3溶液中:c(Na+)-2c(CO${\;}_{3}^{2-}$)-c(HCO${\;}_{3}^{-}$)=10-3-10-11 |
分析 A.盐对应的酸的酸性越强,对应的酸根离子水解程度越小;
B.同浓度的NH4Cl与NaOH溶液等体积混合后,得到氯化钠和一水合氨,一水合氨电离溶液呈碱性;
C.物质的量相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
D.根据溶液中电荷守恒得:2c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),所以c(Na+)-2c(CO32-)-c(HCO3- )=c(OH-)-c(H+ ),由此分析解答.
解答 解:A.因为HF比HCN酸性强,HF比HCN易电离,NaF比NaCN水解程度小,NaF溶液的pH比NaCN溶液的pH小,故A错误;
B.同浓度的NH4Cl与NaOH溶液等体积混合后,得到等浓度的氯化钠和一水合氨,一水合氨电离溶液呈碱性,所以离子浓度大小为:c(Cl-)=c(Na+)>c(OH-)>c(NH4+ )>c(H+),故B错误;
C.NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),所以一水合氨溶液中铵根离子浓度最小;①③中铵根离子系数都是1,醋酸根离子促进铵根离子水解,铝离子抑制铵根离子水解,所以①>③;②中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度,则溶液中铵根离子浓度从小到大顺序是②>①>③>④,故C错误;
D.根据溶液中电荷守恒得:2c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),所以c(Na+)-2c(CO32-)-c(HCO3- )=c(OH-)-c(H+ )=10-3-10-11,故D正确;
故选D.
点评 本题考查了离子浓度大小的比较,特别是C中铵根离子浓度的比较,先根据强弱电解质进行分离,再根据铵根离子系数进行分类,最后根据其它离子对铵根离子的影响来分类即可,难度中等.

| A. | HBrO4的酸性比HClO4的酸性强 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是无色、有毒且无硫化氢稳定的气体 |
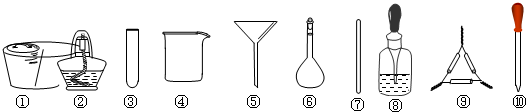
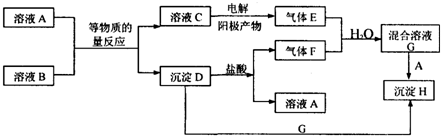
| A. | 将干海带剪碎后灼烧灰化,选用①、②和⑨ | |
| B. | 将海带灰加入蒸馏水搅拌煮沸,选用④、⑥和⑦ | |
| C. | 过滤得到的滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的I-,选用③、⑧和⑩ |
| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | (CH3)2C=CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 | |
| D. | 苯分子的比例模型: |
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
| A. | 通氧气的电极为阳极,发生氧化反应 | |
| B. | 电池放电时,外电路电子由通氧气的正极流向通氢气的负极 | |
| C. | 正极的电极反应为:4OH-→O2↑+2H2O+2e- | |
| D. | 电池工作时,CO${\;}_{3}^{2-}$向负极移动 |
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |