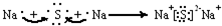题目内容
5.甲苯和甘油组成的混合物在氧气中完全燃烧,下列说法正确的是( )| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
分析 A、甲苯的分子式为C7H8,甘油的分子式为C3H8O3,两者中氢原子个数相同;
B、甲苯和甘油中的氢元素的百分含量均相同;
C、1mol甲苯燃烧消耗9mol氧气,1mol甘油燃烧消耗3.5mol氧气;
D、1mol甲苯即92g甲苯燃烧消耗9mol氧气,1mol甘油即92g甘油燃烧消耗3.5mol氧气,据此分析.
解答 解:A、甲苯的分子式为C7H8,甘油的分子式为C3H8O3,两者中氢原子个数相同均为8个,故只要混合物的总物质的量一定,无论两者所占的比例如何,生成的水的物质的量为定值,故A错误;
B、甲苯和甘油中的氢元素的百分含量均为ω%=$\frac{8}{92}$×100%=$\frac{2}{23}$×100%,故只要混合物的总质量一定,无论两者所占的比例如何,混合物所生成的水的质量为定值,故B正确;
C、1mol甲苯燃烧消耗9mol氧气,而1mol甘油燃烧消耗3.5mol氧气,当总物质的量一定时,若甲苯所占的比例大,则耗氧高,若甘油的所占的比例大,则混合物的耗氧量低,即混合物的耗氧量与甲苯和甘油所占的比例有关,不是定值,故C错误;
D、1mol甲苯即92g甲苯燃烧消耗9mol氧气,1mol甘油即92g甘油燃烧消耗3.5mol氧气,故当总质量一定时,甲苯的含量高,则耗氧量高,甘油的含量低,则耗氧量低,即混合物的含氧量与两者的含量有关,不是定值,故D错误.
故选B.
点评 本题考查了混合物在一定物质的量和一定质量时的耗氧量和生成物量的考查,应注意的是甲苯和甘油中氢原子个数、相对分子质量和氢元素的百分含量相同,同时,在审题时应注意看清题目所给的信息.

练习册系列答案
相关题目
16.实验室中,下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
20.证明溴乙烷中溴的存在,下列正确的操作步骤为( )
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热 ④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ③⑥⑤① |
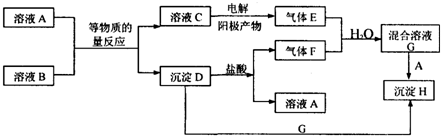
17.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
14.H、C、N、O、都属于自然界中常见非金属元素.
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
结合数据说明CO比N2活泼的原因CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂.
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
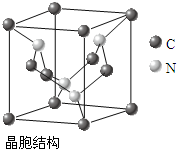
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.
(1)O、C、N三种元素的第一电离能由小到大顺序是C O N;NH4+中氮原子轨道的杂化类型为sp3杂化.
(2)CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键.
(4)C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为:C3N4.

15.CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在其他条件不变的情况下( )
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 反应物总能量小于生成物总能量 | |
| C. | 升高温度,反应速率加快,但反应的△H不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
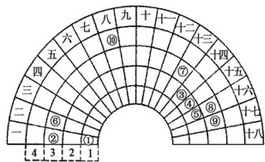 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,请回答下列问题