题目内容
20.0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态的水,放出649.5KJ热量,其热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;又已知:H2O(l)=H2O(g);△H=+44KJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是1016.5KJ.
分析 0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,根据盖斯定律写出其热化学反应方程式,后根据物质的物质的量与反应放出的热量成正比来解答.
解答 解:0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
②H2O(l)→H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ/mol,
11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ/mol×0.5mol=1016.5kJ,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;1016.5.
点评 本题考查燃烧热的热化学方程式的书写、焓变求算,题目难度不大,注意表示热化学方程式的书写要注明物质聚集状态和反应热的正负号问题.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
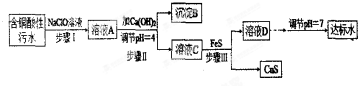
10.欲将某铜矿加工厂产生的含铜酸性污水(如表-1所示)处理成达标水,并回收某些金属化合物,设计如下工艺流程:
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
②国家规定含铜污水排放标准为:pH=7;c(Cu2+)≤1.0×10-7mol•L-1;铁元素含量低于1.0×10-5mol•L-1.
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
请回答:
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).

相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
11.下列说法错误的是( )
| A. | 化学反应速率越快,反应现象越明显 | |
| B. | 需要加热才能进行的化学反应不一定是吸热反应 | |
| C. | 仅由非金属元素组成的化合物中可能含离子键 | |
| D. | ⅠA族金属元素是同周期中金属性最强的元素 |
8.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④沸点:NH3>ASH3>PH3
⑤晶体的熔点:金刚石>NaCl>CCl4>SO2.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>F
③酸性:H3PO4>H2SO4>HClO4
④沸点:NH3>ASH3>PH3
⑤晶体的熔点:金刚石>NaCl>CCl4>SO2.
| A. | ②④⑤ | B. | ①②④ | C. | ③⑤ | D. | 全部正确 |
15.下列关于燃烧的说法正确的是( )
| A. | 燃烧一定要有氧气参加 | B. | 有发光现象的变化一定是燃烧 | ||
| C. | 燃烧一定有发光发热现象 | D. | 燃烧的生成物一定有气体 |
5.下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )
| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
12.对于结构简式为如图的烃,下列说法正确的是( )
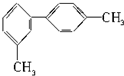

| A. | 分子中至少有6个碳原子处于同一平面上 | |
| B. | 分子中至少有8个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有14个碳原子处于同一平面上 |
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |
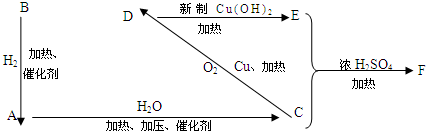
 CH3COOCH2CH3+H2O,反应类型是取代反应.
CH3COOCH2CH3+H2O,反应类型是取代反应.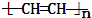 ,反应类型是加聚反应.
,反应类型是加聚反应.