题目内容
14.常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示:以下说法正确的是( )
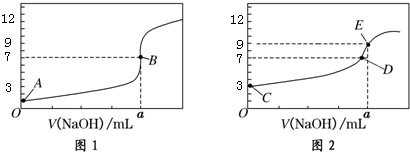
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
分析 A.图1中0.1000mol/L酸的pH=1,而醋酸为弱酸,0.1000mol/L的醋酸的pH一定>1;
B.用氢氧化钠滴定醋酸,滴定终点时溶液由橙色变为黄色;
C.D点溶液为中性,则c(Na+)=c(CH3COO-)、c(OH-)=c(H+);
D.酸、碱溶液抑制了水的电离,C点中的氢氧根离子、E点中的氢离子是水电离的,据此结合溶液的pH计算出水电离的氢离子浓度之比.
解答 解:A.图1中0.1000mol/L酸的pH=1,说明该酸在溶液中完全电离,为强电解质,而醋酸为弱酸,0.1000mol/L的醋酸的pH一定>1,图1应该为盐酸、图2为醋酸,故A错误;
B.图2为氢氧化钠溶液滴定醋酸,甲基橙变色范围为3.1-4.4,颜色为红、橙、黄,当滴定终点时溶液颜色应该由橙色变为黄色,故B错误;
C.根据图示可知,D点为中性,则c(OH-)=c(H+),结合电荷守恒可知:c(Na+)=c(CH3COO-),溶液中正确的离子浓度大小为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C错误;
D.C点为酸溶液,pH=3的醋酸中,氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢离子浓度为10-11mol/L,E点为碱性溶液,NaOH过量,氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,则水电离的氢离子浓度为10-9mol/L,故C、E两点水电离的氢离子浓度之比为:10-11mol/L:10-9mol/L=1:100,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度定性比较等知识,题目难度中等,注意掌握酸碱混合的定性判断方法,明确溶液酸碱性与溶液pH的关系,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.

| A. | △H>0、△S>0 | B. | △H<0、△S<0 | C. | △H<0、△S>0 | D. | △H>0、△S<0 |
| A. | 植物油不能使溴的四氯化碳溶液褪色( ) | |
| B. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型不同 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
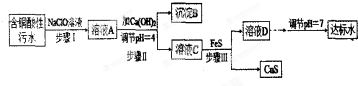
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
| A. | 质子数相同的微粒,它们的化学性质基本相同 | |
| B. | 任何原子的原子核都是由质子和中子构成 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的长式元素周期表中,最长的周期含36种元素 |