题目内容
2.A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-CHO、-C6H5( 代表苯基)中的两种组成,这些化合物的性质如下所述:①A能够发生银镜反应,且相对分子质量为44;
②B溶液加入氯化铁溶液中,溶液显紫色;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应.
请回答下列问题:
(1)B、D的结构简式是:B
 D
D
(2)写出A发生银镜反应的化学方程式:CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+H2O+2Ag↓+3NH3
(3)C和E发生酯化反应的化学方程式:CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O.
分析 A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-CHO、-C6H5( 代表苯基)中的两种组成,
①A能够发生银镜反应,说明含有醛基,且相对分子质量为44,为乙醛,结构简式为CH3CHO;
②B溶液加入氯化铁溶液中,溶液显紫色,说明含有酚羟基,其结构简式为 ;
;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,则一种物质是醇、一种物质是羧酸,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能,C为酸、E为醇,C为CH3COOH、E为CH3OH,二者反应生成乙酸甲酯;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应,说明D中含有苯环且苯环上含有甲基,则D为 ,再结合题目分析解答.
,再结合题目分析解答.
解答 解:A、B、C、D、E五种有机物,它们的分子分别由-CH3、-OH、-COOH、-CHO、-C6H5( 代表苯基)中的两种组成,
①A能够发生银镜反应,说明含有醛基,且相对分子质量为44,为乙醛,结构简式为CH3CHO;
②B溶液加入氯化铁溶液中,溶液显紫色,说明含有酚羟基,其结构简式为 ;
;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,则一种物质是醇、一种物质是羧酸,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能,C为酸、E为醇,C为CH3COOH、E为CH3OH,二者反应生成乙酸甲酯;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应,说明D中含有苯环且苯环上含有甲基,则D为 ,
,
(1)B、D的结构简式分别是: 、,
、,
故答案为: ;
;
(2)A为乙醛,乙醛和银氨溶液加热生成乙酸铵、Ag、氨气和水,反应方程式为:CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+H2O+2Ag↓+3NH3,故答案为:CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$CH3COONH4+H2O+2Ag↓+3NH3;
(3)C为CH3COOH、E为CH3OH,二者反应生成乙酸甲酯,化反应的化学方程式为:CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O,
故答案为:CH3COOH+CH3OH$→_{△}^{浓硫酸}$CH3COOCH3+H2O.
点评 本题考查有机物推断,侧重考查学生分析判断能力,明确常见有机物官能团及其性质是解本题关键,知道常见有机反应现象,易错点是银镜反应方程式的书写,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,各组分浓度不变,v(正)=v(逆)=0 | |
| C. | 任何可逆反应的进程都有一定的限度,只是不同的反应限度不同 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
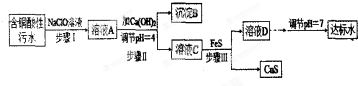
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
| A. | 14C原子与C60中普通碳原子的化学性质相同 | |
| B. | 14C原子与14N原子所含中子数相同 | |
| C. | 14C是C60的同素异形体 | |
| D. | 14CO与12CO、13CO是碳元素的三种同位素 |
| A. | 质子数相同的微粒,它们的化学性质基本相同 | |
| B. | 任何原子的原子核都是由质子和中子构成 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的长式元素周期表中,最长的周期含36种元素 |
| A. | 气体的压强不变 | B. | 气体平均相对分子质量不变 | ||
| C. | 气体的密度不变 | D. | B物质的量浓度不变 |
| A. | 化学反应速率越快,反应现象越明显 | |
| B. | 需要加热才能进行的化学反应不一定是吸热反应 | |
| C. | 仅由非金属元素组成的化合物中可能含离子键 | |
| D. | ⅠA族金属元素是同周期中金属性最强的元素 |
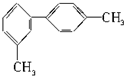
| A. | 分子中至少有6个碳原子处于同一平面上 | |
| B. | 分子中至少有8个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有14个碳原子处于同一平面上 |