题目内容
15.写出下列反应的化学方程式并判断反应类型(1)乙烷与Cl2在光照条件下1:1反应:
 、取代反应
、取代反应(2)3-甲基-1-丁炔与溴的四氯化碳溶液按物质的量为1:1反应:CH≡C-CH(CH3)-CH3+Br2→CHBr=CBr-CH(CH3)-CH3、加成反应
(3)甲苯与浓硝酸、浓硫酸混合制TNT:
 、取代反应.
、取代反应.
分析 (1)乙烷与Cl2在光照条件下1:1反应发生取代反应生成一氯乙烷和氯化氢;
(2)3-甲基-1-丁炔与溴的四氯化碳溶液按物质的量为1:1发生加成反应;
(3)甲苯在浓硫酸作用下与浓硝酸发生取代反应生成三硝基甲苯.
解答 解:(1)乙烷与Cl2在光照条件下1:1反应发生取代反应生成一氯乙烷和氯化氢,化学方程式: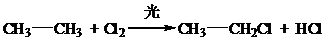 ,反应类型为:取代反应;
,反应类型为:取代反应;
故答案为: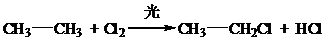 ;取代反应;
;取代反应;
(2)3-甲基-1-丁炔与溴的四氯化碳溶液按物质的量为1:1反应发生加成反应,反应方程式为:CH≡C-CH(CH3)-CH3+Br2→CHBr=CBr-CH(CH3)-CH3,反应类型:加成反应;
故答案为:CH≡C-CH(CH3)-CH3+Br2→CHBr=CBr-CH(CH3)-CH3;加成反应;
(3)甲苯与浓硝酸发生取代反应可生成TNT,即三硝基甲苯,反应的化学方程式为 ,反应类型为取代反应;
,反应类型为取代反应;
故答案为: ;取代反应.
;取代反应.
点评 本题考查有机化学反应方程式书写,把握有机物的结构与性质、官能团与性质的关系为解答的关键,注意有机反应类型及反应条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列所描述的二氧化硫的一些化学性质中,体现二氧化硫作为还原剂的是( )
| A. | 通入溴水溶液使溴水褪色 | B. | 通入品红溶液中,使品红褪色 | ||
| C. | 溶于水形成不稳定的亚硫酸 | D. | 与碱液反应生成亚硫酸盐 |
10.欲将某铜矿加工厂产生的含铜酸性污水(如表-1所示)处理成达标水,并回收某些金属化合物,设计如下工艺流程:
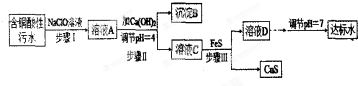
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
②国家规定含铜污水排放标准为:pH=7;c(Cu2+)≤1.0×10-7mol•L-1;铁元素含量低于1.0×10-5mol•L-1.
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
请回答:
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).

相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
7.下列说法正确的是( )
| A. | 质子数相同的微粒,它们的化学性质基本相同 | |
| B. | 任何原子的原子核都是由质子和中子构成 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的长式元素周期表中,最长的周期含36种元素 |
4.下列叙述中,正确的是( )
| A. | O2、O3互为同位素 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同素异形体 | |
| D. | 金刚石、C60互为同分异构体 |
5.下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )
| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |