题目内容
17.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )| A. | R的最高价氧化物对应的水化物的酸性比X的弱 | |
| B. | 非金属性:Y>X | |
| C. | 原子半径的大小顺序:X>Z | |
| D. | Z元素最高价氧化物对应的水化物具有两性 |
分析 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,最外层电子数为4,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素,据此解答.
解答 解:X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,最外层 电子数为4,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的化合物的焰色反应呈黄色,则Z是Na元素;R原子的核外电子数是X原子与Z原子的核外电子数之和,则R的核外电子数是17,所以R是Cl元素.
A.非金属性R(Cl)>X(C),故酸性:高氯酸>碳酸,故A错误;
B.同一周期元素,元素非金属性随着原子序数增大而减弱,所以非金属性O>C,故B正确;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径Z(Na)>X(C),故C错误;
D.Z为Na元素,其最高价氧化物的水化物是NaOH,属于强碱,故D错误,
故选:B.
点评 本题考查原子结构与元素周期律,推断元素是解题的关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列反应属于吸热反应的是( )
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | 过氧化钠与水反应 |
8.下列关于化学反应限度的说法中不正确的是( )
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,各组分浓度不变,v(正)=v(逆)=0 | |
| C. | 任何可逆反应的进程都有一定的限度,只是不同的反应限度不同 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
5.下列说法正确的是( )
| A. | 植物油不能使溴的四氯化碳溶液褪色( ) | |
| B. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型不同 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
12.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 加热能杀死流感病毒式因为病毒的蛋白质受热变性 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
9.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 |
10.欲将某铜矿加工厂产生的含铜酸性污水(如表-1所示)处理成达标水,并回收某些金属化合物,设计如下工艺流程:
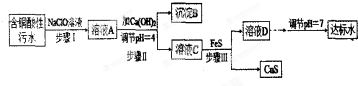
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
②国家规定含铜污水排放标准为:pH=7;c(Cu2+)≤1.0×10-7mol•L-1;铁元素含量低于1.0×10-5mol•L-1.
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
请回答:
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).

相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
11.下列说法错误的是( )
| A. | 化学反应速率越快,反应现象越明显 | |
| B. | 需要加热才能进行的化学反应不一定是吸热反应 | |
| C. | 仅由非金属元素组成的化合物中可能含离子键 | |
| D. | ⅠA族金属元素是同周期中金属性最强的元素 |