题目内容
10.氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
| A. | ③④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑤⑥ |
分析 氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题.
解答 解:氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故错误;
③醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故正确;
④由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故正确;
⑤醋酸的浓度大于盐酸的浓度,则醋酸中反应速率大,所以反应过程中的平均速率 B>A,故正确;
⑥醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故错误;
故选:A.
点评 本题考查弱电解质的电离,结合影响化学反应速率的因素综合考查学生的分析能力,注意把握弱电解质的电离特点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
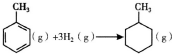 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
18.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号或对应的微粒化学式作答)
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式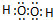 .
.
(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
| 元素 | 原色性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的原子轨道且各种原子轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式
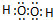 .
.(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
5.在常温下,用pH=11的某碱溶液分别与pH均为3的醋酸溶液和盐酸等体积混合,得到a、b两种溶液,关于这两种溶液的酸碱性的叙述正确的是( )
| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
15.A、B、C、D、E是原子序数依次递增的五种元素(原子序数为5个连续的自然数),下列说法正确的是( )
| A. | B元素的最高化合价为+4价时,其负化合价也可能为-3价 | |
| B. | A(OH)n与HnEOm不能反应 | |
| C. | HnCOm为强酸时,HxDOy一定为强酸 | |
| D. | HnDOm为强酸时,E的非金属性一定很强 |
2.NaH是一种离子化合物,跟水反应的化学方程式为:NaH+H2O═NaOH+H2↑,现有a mol NaH与b mol Al粉混合物跟足量的水反应(a<b),在标准状况下可收集到氢气的量为( )
| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
19.下列物质一定互为同系物的是( )
| A. | C2H4和C3H6 | B. | C2H6和C9H20 | C. | 乙醇和乙酸 | D. | 葡萄糖和果糖 |
20.下列有关人类的营养物质,说法不正确的是( )
| A. | 蔗糖和麦芽糖是互为同分异构体,不是同系物 | |
| B. | 油脂、糖类和蛋白质在一定条件都能发生水解反应 | |
| C. | 淀粉和纤维素的水解产物都可以发生银镜反应 | |
| D. | 蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
 ;
; ;CO2的电子式
;CO2的电子式 ;NH4Cl的电子式
;NH4Cl的电子式 ;
;