题目内容
11.化学术语考查:(1)某元素L层电子数等于K、M层电子数之和,其原子结构示意图
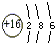 ;
;(2)53号元素I(碘)在周期表中的位置第五周期,第ⅦA族;
(3)Na2O2的电子式
 ;CO2的电子式
;CO2的电子式 ;NH4Cl的电子式
;NH4Cl的电子式 ;
;(4)铋(Bi)的原子序数为83,含有126个中子的核素表示为${\;}_{83}^{209}$Bi.
分析 (1)某元素L层电子数等于K、M层电子数之和,则原子核外各层电子数分别为2、8、6,应为S元素;
(2)53号元素I,原子核外有5的电子层,最外层电子数为7,以此确定元素在周期表中的位置;
(3)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,CO2为共价化合物;NH4Cl是离子化合物;
(4)原子序数为83,含有126个中子的核素的质量数为83+126=209.
解答 解:(1)某元素L层电子数等于K、M层电子数之和,则原子核外各层电子数分别为2、8、6,应为S元素,原子结构示意图为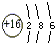 ,故答案为:
,故答案为: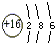 ;
;
(2)53号元素I,原子核外有5的电子层,最外层电子数为7,则应位于周期表第五周期,第ⅦA族,故答案为:第五周期,第ⅦA族;
(3)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
,CO2为共价化合物,电子式为 ,氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:
,氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;故答案为:
;故答案为: ;
; ;
; ;
;
(4)原子序数为83,含有126个中子的核素的质量数为83+126=209,核素可表示为${\;}_{83}^{209}$Bi,故答案为:${\;}_{83}^{209}$Bi.
点评 本题综合考查原子结构、元素周期律、电子式以及原子结构示意图等知识,为高频考点,侧重于化学用语的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
2.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
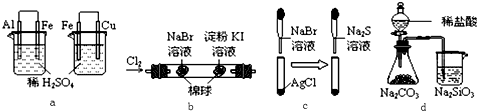

| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl<AgBr<Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
19.下列关于化学平衡常数的说法中错误的是( )
| A. | 化学平衡常数K随温度的升高,K可能增大、减小或不变 | |
| B. | 催化剂不能改变平衡常数的大小 | |
| C. | 对于给定的可逆反应,温度一定时,其正、逆反应的平衡常数可能相等 | |
| D. | 化学平衡移动时,平衡常数不一定改变 |
6.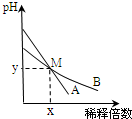 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L | |
| C. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| D. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 |
9.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒、细菌、真菌及芽孢.过氧乙酸可由冰醋酸与过氧化氢在一定条件下反应制得,下列有关过氧乙酸的叙述中正确的是( )
| A. | 过氧乙酸与羟基丙酸(HOCH2CH2COOH)组成上相差一个CH2,故互为同系物 | |
| B. | 苯酚也能杀菌消毒,过氧乙酸与苯酚混合使用,可增强过氧乙酸的杀菌效果 | |
| C. | 由下列过氧乙酸的制取原理可以看出,过氧乙酸属于酯类有机物CH3COOH+H2O2-→CH3COOOH+H2O | |
| D. | 过氧乙酸不仅能使蛋白质变性,同时还具有漂白性,其漂白原理与双氧水相同 |
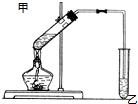 如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: CH3COOC2H5+H2O
CH3COOC2H5+H2O .
.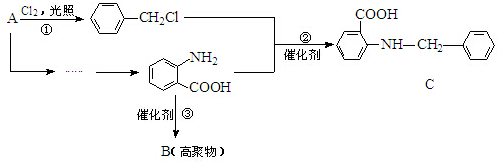
 (弱碱,易被氧化)
(弱碱,易被氧化) .
.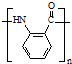 ;反应③的有机反应类型:缩聚反应.
;反应③的有机反应类型:缩聚反应. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: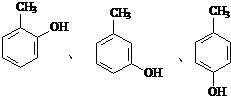 .
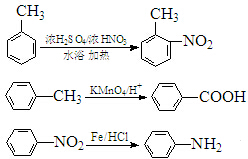
.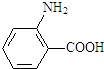 →B
→B 等.
等.