题目内容
15.A、B、C、D、E是原子序数依次递增的五种元素(原子序数为5个连续的自然数),下列说法正确的是( )| A. | B元素的最高化合价为+4价时,其负化合价也可能为-3价 | |
| B. | A(OH)n与HnEOm不能反应 | |
| C. | HnCOm为强酸时,HxDOy一定为强酸 | |
| D. | HnDOm为强酸时,E的非金属性一定很强 |
分析 A.B元素的最高化合价为+4价时,其负化合价也可能为-3价,如C2H6;
B.A可以为Al,E为Cl元素,氢氧化铝能与高氯酸反应;
C.HnCOm为强酸时,C可以为S元素,D为Cl元素,E为Ar,次氯酸属于弱酸;
D.HnCOm为强酸时,按照原子序数依次增大,E可能为稀有气体、可能为非金属.
解答 解:A.B元素的最高化合价为+4价时,可以为ⅣA元素,其负化合价也可能为-3价,如C2H6,故A正确;
B.A可以为Al,E为Cl元素,氢氧化铝能与高氯酸反应,故B错误;
C.HnCOm为强酸时,C可以为S元素,D为Cl元素,E为Ar,次氯酸属于弱酸,故C错误;
D.HnDOm为强酸,即D元素的非金属性很强,原子序数比D大1的E可能为非金属性比D强的非金属元素,也可能为稀有气体元素,故D错误,
故选A.
点评 本题考查位置结构性质的相互关系,题目难度不大,注意利用列举法、反例法进行解答.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
6.下列表示式正确的是( )
| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: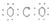 | D. | Na+的轨道表示式为: |
3.下列实验操作正确的是( )
| A. | 给容量瓶中加水时,借助于玻璃棒,给滴定管中装液时,借助于漏斗 | |
| B. | 用梨形分液漏斗做萃取实验时,检漏该分液漏斗上口的方法与检漏容量瓶一样,检漏下方活塞的方法与检漏滴定管一样 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较 | |
| D. | 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯的外焰加热;水浴加热可以不用温度计 |
10.氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
| A. | ③④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑤⑥ |
4.一个原电池的总反应方程式为Zn+Cu2+═Zn2++Cu,该电池可能为( )
| 选项 | A | B | C | D |
| 正极 | Cu | Mg | C | Zn |
| 负极 | Zn | Zn | Zn | Cu |
| 电解质溶液 | H2SO4 | CuSO4 | CuCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
5. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 当溶液中固体质量不再变化时达到平衡状态 |
 .
. ,请回答以下问题:
,请回答以下问题: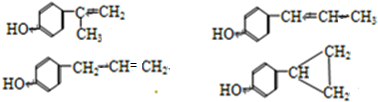
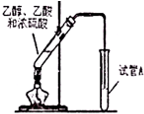 “酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯.
“酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.