题目内容
5.在常温下,用pH=11的某碱溶液分别与pH均为3的醋酸溶液和盐酸等体积混合,得到a、b两种溶液,关于这两种溶液的酸碱性的叙述正确的是( )| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
分析 根据pH为3的醋酸和盐酸溶液,盐酸的浓度小,再讨论pH为11的某碱溶液,利用等体积混合反应后溶液中的溶质来分析溶液的酸碱性.
解答 解:A.如果碱是强碱,碱和盐酸的浓度相等,等体积混合二者恰好反应生成强酸强碱盐,其溶液呈中性,如果碱是弱碱,混合后碱有剩余,溶液呈碱性,故A错误;
B.如果碱是强碱,醋酸的浓度大于碱,二者等体积混合时酸有剩余,溶液呈酸性,故B错误;
C.如果碱是强碱,碱和盐酸的浓度相等,等体积混合二者恰好反应生成强酸强碱盐,其溶液呈中性,如果碱是弱碱,混合后碱有剩余,溶液中碱电离程度要远远大于碱离子水解程度,所以溶液呈碱性,所以b不可能显酸性,故C正确;
D.如果碱是弱碱,碱的浓度大于醋酸,二者等体积混合时碱有剩余,溶液呈碱性,故D错误;
故选C.
点评 本题考查溶液酸碱性的定性分析,明确pH为11的某碱可能为强碱或弱碱,明确盐与酸的溶液一般显酸性、盐与碱的溶液一般显碱性是解答的关键,此题应忽略盐中离子水解趋势与弱电解质电离趋势的比较来解答,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.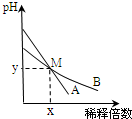 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L | |
| C. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| D. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 |
16.下列说法中正确的是( )
| A. | 丙烯能使溴的四氯化碳溶液褪色,还可能在一定条件下与溴发生取代反应 | |
| B. | 正丁烷比丙烷难液化 | |
| C. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| D. | 乙醇的催化氧化也属于加成反应 |
13.下列化学实验事实及其相应结论都正确的是( )
| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
10.氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
| A. | ③④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑤⑥ |
17.表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)
(1)据表中数据,总结烯类化合物与溴发生加成反应时,反应速率与碳酸双键上取代基的种类、个数间的关系为碳碳双键上的烷基取代基越多越有利于加成,有卤素原子不利于加成
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为
 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4,并用质谱仪器探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
15.下列反应不可能作为原电池工作时发生的反应的是( )
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Fe+O2+2H2O═2Fe(OH)2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2H2+O2═2H2O |
