题目内容
2.NaH是一种离子化合物,跟水反应的化学方程式为:NaH+H2O═NaOH+H2↑,现有a mol NaH与b mol Al粉混合物跟足量的水反应(a<b),在标准状况下可收集到氢气的量为( )| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
分析 NaH与水反应方程式为NaH+H2O═NaOH+H2↑①,Al与NaOH溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑②,将方程式2×①+②得2NaH+4H2O+2Al=2NaAlO2+5H2↑,因为a<b,所以Al有剩余,以NaH为标准计算生成氢气体积或物质的量.
解答 解:NaH与水反应方程式为NaH+H2O═NaOH+H2↑①,Al与NaOH溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑②,将方程式2×①+②得2NaH+4H2O+2Al=2NaAlO2+5H2↑,因为a<b,所以Al有剩余,
设生成氢气物质的量为x,
2NaH+4H2O+2Al=2NaAlO2+5H2↑
2mol 5mol
amol x
2mol:5mol:amol:x
x=$\frac{5mol×amol}{2mol}$=2.5amol
氢气体积=2.5amol×22.4L/mol=56aL,
故选A.
点评 本题考查化学方程式的有关计算,侧重考查学生分析计算能力,能正确将NaH、Al融合在一个方程式中是解本题关键,注意进行过量计算,为易错题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列化学实验事实及其相应结论都正确的是( )
| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
10.氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
| A. | ③④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑤⑥ |
17.表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)
(1)据表中数据,总结烯类化合物与溴发生加成反应时,反应速率与碳酸双键上取代基的种类、个数间的关系为碳碳双键上的烷基取代基越多越有利于加成,有卤素原子不利于加成
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为
 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4,并用质谱仪器探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
11.山梨酸是一种常见的食物添加剂,它的结构简式为CH3-CH=CH-CH-CH-COOH,下列关于山梨酸的叙述正确的是( )
| A. | 山梨酸不能使溴水褪色 | B. | 山梨酸中的含氧官能团为羟基 | ||
| C. | 1mol山梨酸最多与2molH2加成 | D. | 山梨酸能与NaHCO3发生反应 |
12.短周期中的主族元素M、R(M、R代表元素符号)形成的简单离子M2-与R+的核外电子数之和为20,下列说法中,正确的是( )
| A. | M原子所含质子数一定大于R原子所含质子数 | |
| B. | M、R两种元素结合形成的化合物中不可能含有共价键 | |
| C. | M2-与R+的电子层结构不可能相同 | |
| D. | M一定存在同素异形体 |
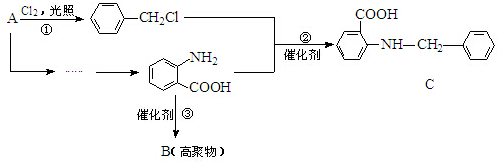
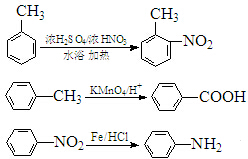 (弱碱,易被氧化)
(弱碱,易被氧化) .
.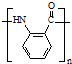 ;反应③的有机反应类型:缩聚反应.
;反应③的有机反应类型:缩聚反应. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: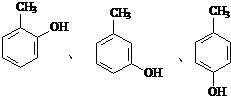 .
.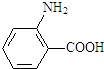 →B
→B 等.
等.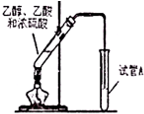 “酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯.
“酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.