题目内容
1.下列说法正确的是( )| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
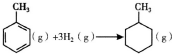 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
分析 A、CH3COONa在溶液中的水解程度较小;
B、氟化氢溶液是弱酸溶液存在电离平衡,加水稀释促进电离;
C、苯环中不存在C-C键和C=C键;
D、氯化铵在溶液中的铵根离子抑制一水合氨的电离.
解答 解:A、溶液中CH3COO-会发生水解,水解程度小,所以c(CH3COOH)<c(CH3COO-),故A错误;
B、氟化氢是弱电解质存在电离平衡,加水稀释弱酸促进电离,氢离子物质的量增大,氟化氢物质的量减小,所以$\frac{c({H}^{+})}{c(HF)}$始终保持增大,故B正确;
C、苯环中不存在C-C键和C=C键,不知道苯环中C与C之间的共价键的键能,所以不能求出该反应的反应热,故C错误;
D、常温下,在0.10mol•L-1氨水中加入少量NH4Cl晶体,铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度减小,溶液PH减小,故D错误;
故选B.
点评 本题考查了盐类水解、离子浓度大小比较及其变化、键能与反应热,注意弱电解质电离平衡的理解应用和影响因素,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
2.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
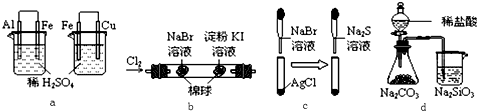

| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl<AgBr<Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
9.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒、细菌、真菌及芽孢.过氧乙酸可由冰醋酸与过氧化氢在一定条件下反应制得,下列有关过氧乙酸的叙述中正确的是( )
| A. | 过氧乙酸与羟基丙酸(HOCH2CH2COOH)组成上相差一个CH2,故互为同系物 | |
| B. | 苯酚也能杀菌消毒,过氧乙酸与苯酚混合使用,可增强过氧乙酸的杀菌效果 | |
| C. | 由下列过氧乙酸的制取原理可以看出,过氧乙酸属于酯类有机物CH3COOH+H2O2-→CH3COOOH+H2O | |
| D. | 过氧乙酸不仅能使蛋白质变性,同时还具有漂白性,其漂白原理与双氧水相同 |
16.下列说法中正确的是( )
| A. | 丙烯能使溴的四氯化碳溶液褪色,还可能在一定条件下与溴发生取代反应 | |
| B. | 正丁烷比丙烷难液化 | |
| C. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| D. | 乙醇的催化氧化也属于加成反应 |
6.下列表示式正确的是( )
| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: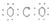 | D. | Na+的轨道表示式为: |
13.下列化学实验事实及其相应结论都正确的是( )
| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
10.氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是( )
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
①反应所需要的时间 B>A ②开始反应时的速率A>B ③盐酸里有锌剩余 ④参加反应的锌的物质的量 A=B⑤反应过程的平均速率B>A ⑥醋酸里有锌剩余.
| A. | ③④⑤ | B. | ③④⑥ | C. | ②③⑤ | D. | ②③⑤⑥ |
11.山梨酸是一种常见的食物添加剂,它的结构简式为CH3-CH=CH-CH-CH-COOH,下列关于山梨酸的叙述正确的是( )
| A. | 山梨酸不能使溴水褪色 | B. | 山梨酸中的含氧官能团为羟基 | ||
| C. | 1mol山梨酸最多与2molH2加成 | D. | 山梨酸能与NaHCO3发生反应 |
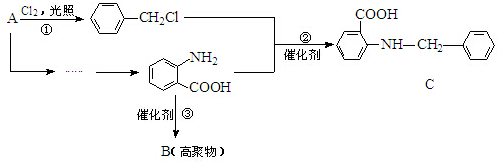
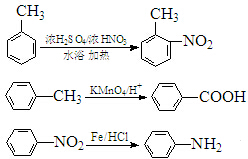 (弱碱,易被氧化)
(弱碱,易被氧化) .
.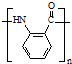 ;反应③的有机反应类型:缩聚反应.
;反应③的有机反应类型:缩聚反应. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: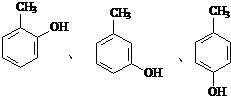 .
.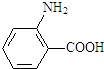 →B
→B 等.
等.