题目内容
16.现代工业放琉涉及到反应:2NaHS+4NaVO3+H2O=Na2V4O9+4NaOH+2S,下列说法正确的是( )| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
分析 A.根据H2O中O原子的价层电子对数判断杂化类型和分子构型;
B.反应中S的化合价从-2价升高到0价;
C.NaHS中钠离子与硫氢根离子形成离子键,还存在H-S键;
D.硫单质(S8)中存在分子.
解答 解:A.H2O中O原子的价层电子对数为2+$\frac{6-2×1}{2}$=4,属于sp3杂化,含有2个孤电子对,其分子的空间构型为V形,故A错误;
B.反应中S的化合价从-2价升高到0价,则反应中每生成1molS转移了2mol电子,故B正确;
C.NaHS中钠离子与硫氢根离子形成离子键,还存在H-S极性键,不含有非极性键,故C错误;
D.硫单质(S8)中存在S8分子,属于分子晶体,不是原子晶体,故D错误.
故选B.
点评 本题考查了分子空间类型的判断、氧化还原反应、化学键、晶体类型,题目难度不大,侧重于基础知识的考查,注意把握分子空间类型的判断方法.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
7.T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
(1)Z元素位子周期表中第_VIII族,其基态原子的价层电子排布式为:3d64s2;
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
| 元素符号 | 元素性质或原子结构 |
| T | 其一种无色氧化物遇空气变为红棕色 |
| W | 其单质和化合物的焰色反应焰色均呈黄色 |
| X | 基态原子的最外层电子排布式为(n+1)sn(n+1)pn+2 |
| Y | 单质常温下为气体,可用于自来水消毒 |
| Z | 一种核素的质量数为56,中子数为30 |
(2)T的一种化合物为T2H4,该分子中极性键和非极性键的数目之比为4:1:T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于离子晶体.
(3)W、X和Y三种元素中,第一电离能最小的为Na(填元素符号);W、X和Y的简单离子的半径从小到大的顺序为Na+<Cl-<S2-(用离子符号表示).
(4)Z与水蒸气反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
4.在催化剂表面NH3脱硫的原理为:8NH3(g)+6SO2(g)═3S2(g)+4N2(g)+12H2O(g)△H,实验测定在不同n(NH3)/n(SO2)下,温度与SO2的转化率关系如图,下列说法正确的是( )

| A. | 脱硫反应△H<0 | |
| B. | n(NH3)/n(SO2):a<b<c | |
| C. | 相同条件下,催化剂活性越大,SO2的平衡转化率越高 | |
| D. | 及时从体系中除去水,平衡常数增大 |
11.下列说法正确的是( )
| A. | 已知X在一定条件下转化为Y,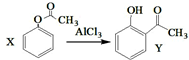 ,X与Y互为同系物,可用FeBr3溶液鉴别 ,X与Y互为同系物,可用FeBr3溶液鉴别 | |
| B. | 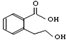 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物有5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
2.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(少量杂质忽略不计)( )
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2 溶液$\stackrel{NaCO_{3}溶液}{→}$NaOH溶液 | |
| C. | Fe$\stackrel{点燃}{→}$ $F{e}_{2{O}_{3}}$$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3溶液 | |
| D. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 |

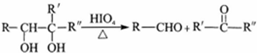
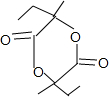 +2H2O.
+2H2O.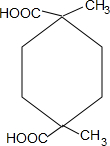 .
.
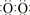 ]2-Na+
]2-Na+