题目内容
6.下列说法不正确的是( )| A. | 在船外壳镶嵌锌块保护船身,锌为原电池的负极 | |
| B. | MgO的熔点高于NaCl,是因为MgO的晶格能大于NaCl | |
| C. | 1molFeCl3完全水解将产生6.02×1023个胶体粒子 | |
| D. | 水的离子积常数Ksp随着温度的升高而增大,说明水的电离是吸热过程 |
分析 A.原电池的正极金属易被保护,不易腐蚀;
B.均为离子晶体,晶格能大的熔点高,晶格能与离子半径与离子电荷有关;
C.Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒;
D.水的离子积随温度升高增大,说明氢离子和氢氧根离子浓度增大,所以水的电离是吸热过程.
解答 解:A.海轮外壳镶嵌锌块,锌为原电池的负极,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,故A正确;
B.决定晶格能的因素为:离子电荷、离子半径、离子的电子层构型,MgO所带电荷多,MgO的熔点高于NaCl,故B正确;
C.Fe(OH)3胶体粒子是由Fe(OH)3“分子”聚合成的较大颗粒,含1molFe3+的FeCl3完全水解,产生Fe(OH)3胶体粒子小于6.02×1023,故C错误;
D.水的离子积随温度升高增大,说明氢离子和氢氧根离子浓度增大,促进水的电离,所以水的电离是吸热过程,故D正确.
故选C.
点评 本题考查金属腐蚀、晶格能、胶体和离子积,题目难度不大,做题时注意物质的组成、结构、性质以及存在的状态和条件等问题.

练习册系列答案
相关题目
16.如图所示的电化学装置,电解质溶液为Na2SO4,下列说法不正确的是( )


| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
17.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
14.已知草酸(H2C2O4)是一种二元弱酸,草酸及其盐广泛用于医药、印染、塑料等工业.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
①25℃时,浓度均为0.1mol•L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3的pH由大到小的顺序是Na2CO3>NaCN>CH3COONa>Na2C2O4.中和等体积、等pH的HCOOH和HCN消耗NaOH的量后者大(填“前者大”“后者大”或“相等”).
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
(1)已知25℃时,几种常见弱酸的Ka如下表所示:
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数(mol•L-1) | K1=5.6×10-2 K2=5.4×10-3 | K1=1.7×10-5 | K2=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
②下列关于0.1mol•L?1NaHC2O4溶液的说法正确的是ad.
a.HC2O4-的电离程度大于水解程度,溶液显酸性
b.HC2O4-的水解程度大于电离程度程度,溶液显碱性
c.溶液中c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.溶液中c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
(2)在t℃时,MgC2O4在水中的沉淀溶解平衡曲线如图1所示.又知t℃时Mg(OH)2的Ksp=5.6×10-12,下列说法不正确的是BD.
A.在t℃时,MgC2O4的Ksp=8.1×10-5(mol•L-1).
B.在MgC2O4饱和溶液中加入Na2CO3固体,可使溶液由c点到b点
C.图中a点对应的是MgC2O4的不饱和溶液
D.在t℃时,MgC2O4 (s)+2OH-(aq)?Mg(OH)2(s)+C2O42-(aq)平衡常数K=Ksp[Mg(OH)2]/Ksp (MgC2O4)

(3)草酸亚铁晶体(FeC2O4•2H2O)是一种浅黄色固体,难溶于水,受热易分解.某化学兴趣小组设计实验验证草酸亚铁晶体热分解的产物,探究过程如图2:
①从环保角度考虑,该套实验装置的明显缺陷是缺少尾气处理装置.
②该兴趣小组进行上述实验时,从实验安全角度考虑,应先点燃A(填“A”或“E”)处的酒精灯.
③若实验过程中观察到B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中黑色粉末变红色.(补充实验现象),则可证明草酸亚铁晶体热分解的气体产物是H2O、CO和CO2.
④为探究草酸亚铁晶体分解的固体产物,兴趣小组同学准确称取3.60g草酸亚铁晶体(FeC2O4•2H2O),相对分子质量是180),充分加热,使其完全分解,冷却后称得剩余固体的质量为1.60g.若剩余固体只有一种铁的氧化物,通过计算确定该氧化物的化学式为Fe2O3.草酸亚铁晶体分解的化学方程式为FeC2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3CO↑+CO2↑+2H2O.
1.下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
11.下列关于各实验装置图的叙述中正确的是( )
| A. | 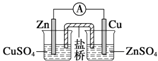 装置:构成锌-铜原电池 | |
| B. | 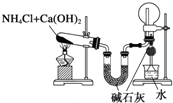 装置:实验室制氨气并收集干燥的氨气 | |
| C. | 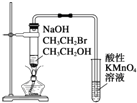 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 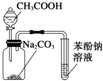 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
18.W、M、X、Y、Z是四种短周期元素,M、X、Y处于同一周期,X的主族序数是周期序数的2倍,Y2-、Z+、W2+、M-的电子层结构相同,下列说法正确的是( )
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
15.下列实验操作正确的是( )
| A. | 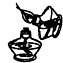 点燃酒精灯 | B. | 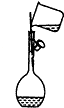 向容量瓶转移液体 | ||
| C. | 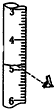 读取液体体积 | D. | 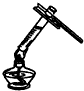 加热液体 |
16.现代工业放琉涉及到反应:2NaHS+4NaVO3+H2O=Na2V4O9+4NaOH+2S,下列说法正确的是( )
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |