题目内容
2.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是(少量杂质忽略不计)( )| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2 溶液$\stackrel{NaCO_{3}溶液}{→}$NaOH溶液 | |
| C. | Fe$\stackrel{点燃}{→}$ $F{e}_{2{O}_{3}}$$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3溶液 | |
| D. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 |
分析 A.一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸;
B.理论上正确,操作较为简便,利用碳酸钠获得氢氧化钠,经济上也合理;
C.铁在氧气中燃烧生成四氧化三铁;
D.银比铜要贵重,经济上不合理.
解答 解:A.碳不完全燃烧可生成一氧化碳,一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,一氧化碳是有毒的气体,碳在氧气中燃烧生成的进行实验时要进行尾气处理,且一氧化碳是可燃性气体,不纯时加热或点燃引起爆炸,操作上较为复杂,故A错误;
B.氧化钙与水反应可生成Ca(OH)2,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理,故B正确;
C.铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的,故C错误;
D.铜与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,银比铜要贵重,利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理,故D错误;
故选B.
点评 本题考查实验制备方案设计与评价、绿色化学等知识,题目难度中等,是理论知识联系生活实际的体现、理论知识对实际的指导;注意实验方案设计必须满足理论正确、操作简单可行、经济节约、绿色环保.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
16.现代工业放琉涉及到反应:2NaHS+4NaVO3+H2O=Na2V4O9+4NaOH+2S,下列说法正确的是( )
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
13.下列有关化学实验原理、现象或结论的描述不正确的是( )
| A. | 用CoCl2溶液浸泡过的棉花制成简易湿度计,悬挂在家中,以粗略估计空气的湿度 | |
| B. | 在1mL0.5mol/L的AlCl3溶液中加入2mL饱和的NaF溶液,再加入1mL3.mol/L的氨水,整个过程都无明显现象 | |
| C. | 向1mL1%的NaOH溶液中加入2ml2%的CuSO4溶液,振荡后再加入0.5mL有机物X,溶液呈现绛蓝色,则X是甘油 | |
| D. | 用标准NaOH溶液滴定待测食醋溶液时,锥形瓶水洗后未用待测液润洗,碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果偏高 |
17.在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛.荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态.下列说法不正确的是( )
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式 | |
| D. | 反应①属于酯水解反应 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8g重水中含有的电子数为NA | |
| B. | 1L0.1mol/L FeCl3溶液中含有的Cl- 数为0.3NA | |
| C. | 25℃,1L pH=13的Ba(OH)2溶液中含有的oH-数为0.2NA | |
| D. | 标准状况下,2.24L NO和NO2混合气体中含有的氧原子数为0.15NA |
12.下列说法错误的是( )
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大 | |
| D. | 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大 |
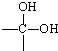 →
→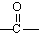 +H2O烃A(分子式为C9H8)有如图的转化关系:
+H2O烃A(分子式为C9H8)有如图的转化关系:
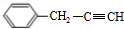 ,指出反应①的反应类型:加成反应.
,指出反应①的反应类型:加成反应. .
.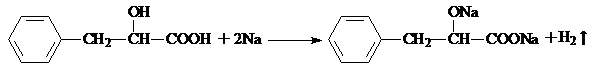 .
.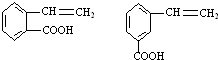 ,请写出其他两种
,请写出其他两种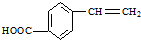 、
、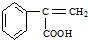 .
. 二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.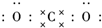 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.