题目内容
15.写出下列物质的电子式:H2O
 CaCl2
CaCl2 N2
N2 OH-
OH-
用电子式表示Na2S的形成过程:
 .
.
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,非金属单质和共价化合物不带电荷,注意各原子或离子满足稳定结构;
水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键;
氯化钙是离子化合物,由钙离子与氯离子构成,必须标出阴阳离子的电荷;
氮气中存在3对共用电子对,氮原子最外层达到8个电子;
氢氧根离子为阴离子,O原子周围8个电子;
硫化钠为离子化合物,根据离子化合物的电子式结合电子转移然后写出Na2S的形成过程.
解答 解:水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,
,
氮气中存在氮氮三键,氮气的电子式为 ,
,
氢氧根离子为阴离子,O原子周围8个电子,其电子式为 ;
;
硫化钠为离子化合物,一个钠原子失去一个电子,一个硫原子得到两个电子,则用电子式表示Na2S的形成过程为: .
.
故答案为: ;
; ;
; ;
; ;
; .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
5.下列物质的化学用语表达正确的是( )
| A. | 甲烷的球棍模型: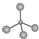 | B. | (CH3)3COH的名称:2,2二甲基乙醇 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 羟基的电子式: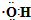 |
6.下列各操作中,正确的是( )
| A. | 为减缓反应速率,用饱和食盐水与电石反应制乙炔 | |
| B. | 进行酸碱中和滴定时,锥形瓶应用待测液润洗 | |
| C. | 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 | |
| D. | 配制FeCl3溶液时,加入少量稀硫酸抑制其水解 |
3.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
20.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
7.在稀硫酸与锌的反应中,硫酸是( )
| A. | 是氧化剂 | B. | 是还原剂 | C. | 被氧化 | D. | 催化剂 |
4.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴水或酸性高锰酸钾溶液可以鉴别1-己烯和乙醛 |
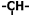 ),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )
),并且乙烯基和次甲基之间必须通过亚甲基相连,当该烃含有单环结构是分子中的乙烯基和亚甲基的个数依次为( )