题目内容
20.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
分析 A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子;
B.氰分子的结构式为N≡C-C≡N,根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键;
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长.
解答 解:A.直接连接三键两端原子的原子与三键两端的原子共线,正负电荷重心重合的分子为非极性分子,该反应中所有原子共线,且该分子的正负电荷重心重合,为非极性分子,故A正确;
B.氰分子的结构式为N≡C-C≡N,氮原子价层电子对个数=σ键个数+孤电子对个数=1+$\frac{1}{2}$(5-3×1)=2,采取sp杂化,故B正确;
C.共价单键是σ键,共价双键中一个是σ键一个是π键,共价三键中一个是σ键两个是π键,所以氰气分子中含有3个σ键和4个π键,故C正确;
D.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,故D错误;
故选D.
点评 本题考查了物质的组成、结构和性质的关系,同时考查学生知识迁移能力,根据已知的乙炔的结构、卤素的性质结合元素周期律以及杂化理论来分析解答,题目难度中等.

练习册系列答案
相关题目
10.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍;N5可以做烈性炸药.下列叙述正确的是( )
| A. | 金刚石和纳米管互为同分异构体 | B. | N5和N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | C原子半径比N原子半径小 |
8.下列各组离子,在所给条件下一定能大量共存的是( )
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
5.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1mol C2H6含有6nA个共价键 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 17gNH3含有10nA个质子 | |
| D. | 1molK被完全氧化生成KO2,失去2nA个电子 |
12.下列各离子组中,在溶液中能够大量共存的一组是( )
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
9.判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.如下表所示
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出它们的结构式分别为 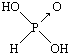 和
和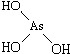 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 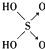 | 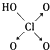 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 和
和 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性(2)亚磷酸和亚砷酸与过量的氢氧化钠溶液反应的化学方程式分别为:①H3PO3+2NaOH=Na2HPO3+2H2O; ②H3AsO3+3NaOH=Na3AsO3+3H2O.
 .
. 或
或 .
. CaCl2
CaCl2 N2
N2 OH-
OH-
 .
.