题目内容
6.下列各操作中,正确的是( )| A. | 为减缓反应速率,用饱和食盐水与电石反应制乙炔 | |
| B. | 进行酸碱中和滴定时,锥形瓶应用待测液润洗 | |
| C. | 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 | |
| D. | 配制FeCl3溶液时,加入少量稀硫酸抑制其水解 |
分析 A.饱和食盐水中水浓度小于纯水;
B.进行酸碱中和滴定时,锥形瓶应不能用待测液润洗;
C.液体混合时,应该将密度大的液体倒入密度小的液体中;
D.配制氯化铁溶液为防止水解应该加稀盐酸.
解答 解:A.饱和食盐水中水浓度小于纯水,所以为减缓反应速率,用饱和食盐水与电石反应制乙炔,故A正确;
B.进行酸碱中和滴定时,锥形瓶应不能用待测液润洗,否则易导致测定值偏大,故B错误;
C.液体混合时,应该将密度大的液体倒入密度小的液体中,所以应该将浓硫酸倒入乙醇中并不断搅拌,故C错误;
D.配制氯化铁溶液为防止水解应该加稀盐酸,如果加入稀硫酸易产生杂质,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及基本操作,明确物质性质、操作规范性是解本题关键,注意从操作规范性进行评价,易错选项是B.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
16.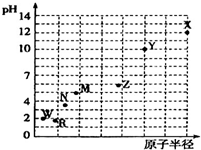 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
17.下列物质一定属于同系物的是( )


| A. | ⑤和⑦ | B. | ③和④? | C. | ①、②和③? | D. | ④、⑥和⑧ |
18.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题
(1)化学性质最不活泼的元素符号是Ne,金属性最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)画出④形成的简单离子的结构示意图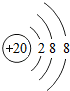 .
.
(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | |||
| 4 | ② | ④ |
(2)画出④形成的简单离子的结构示意图
 .
.(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
16.下列物质中既能与盐酸反应,又能与氢氧化钠溶液反应的组合是( )
①(NH4)2CO3 ②Al2O3 ③Cu(OH)2 ④Al(OH)3 ⑤Na2CO3 ⑥NaHCO3.
①(NH4)2CO3 ②Al2O3 ③Cu(OH)2 ④Al(OH)3 ⑤Na2CO3 ⑥NaHCO3.
| A. | ①②⑤ | B. | ②④⑥ | C. | ①②④⑥ | D. | ①②④⑤ |
 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.
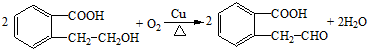 .
.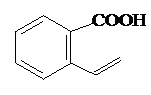 或
或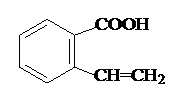 .
. CaCl2
CaCl2 N2
N2 OH-
OH-
 .
.