题目内容
3.下列化学反应的离子方程式正确的是( )| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
分析 A.二者反应生成碳酸氢铵;
B.二者发生氧化还原反应生成硫酸钙;
C.二者反应生成亚硫酸钡、NaOH和水;
D.二者反应生成硫酸钙、水,但氢离子、氢氧根离子和水的计量数都是2.
解答 解:A.二者反应生成碳酸氢铵,离子方程式为NH3•H2O+CO2=NH4++HCO3-,故A正确;
B.二者发生氧化还原反应生成硫酸钙,离子方程式为Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故B错误;
C.二者反应生成亚硫酸钡、NaOH和水,离子方程式为HSO3-+Ba2++OH-=BaSO3↓+H2O,故C错误;
D.二者反应生成硫酸钙、水,但氢离子、氢氧根离子和水的计量数都是2,离子方程式为Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O,故D错误;
故选A.
点评 本题考查离子方程式正误判断,为高频考点,明确物质的性质及离子方程式书写规则即可解答,常常与盐类水解、氧化还原反应联合考查,有些化学反应还与反应物的量有关,易错选项是BD.

练习册系列答案
相关题目
18.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题
(1)化学性质最不活泼的元素符号是Ne,金属性最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑.
(2)画出④形成的简单离子的结构示意图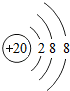 .
.
(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | |||
| 4 | ② | ④ |
(2)画出④形成的简单离子的结构示意图
 .
.(3)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是NaOH.
(4)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
(5)③⑤⑦三种元素形成的简单离子,离子半径由大到小的顺序是O2->Mg2+>Al3+.
(6)设计一个简单实验证明⑧⑨两种元素非金属性强弱的比较将氯气通入Na2S溶液中,如果溶液中出现浅黄色沉淀,就说明氯气的氧化性大于硫,则非金属性Cl>S.
8.下列各组离子,在所给条件下一定能大量共存的是( )
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
12.下列各离子组中,在溶液中能够大量共存的一组是( )
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
 .
. ;
; 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.
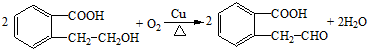 .
.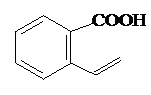 或
或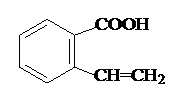 .
. CaCl2
CaCl2 N2
N2 OH-
OH-
 .
.