题目内容
1.表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:Z<M | D. | 得电子能力:X>Y |
分析 Y原子的最外层电子数是内层电子数的3倍,Y有2个电子层,最外层电子数为6,Y为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为Si元素,M为Al元素,结合元素周期律与元素单质化合物性质解答.
解答 解:Y原子的最外层电子数是内层电子数的3倍,Y有2个电子层,最外层电子数为6,Y为O元素,根据四种元素在周期表中的位置可知,X为N元素,Z为Si元素,W为Al元素.
A.非金属性X>Z,故氢化物稳定性X>Z,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Al3+,故B错误;
C.非金属性Z>M,则最高价氧化物对应的水化物的酸性为Z>M,故C错误;
D.非金属性Y>X,得电子能力:Y>X,故D错误,
故选A.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,正确推断元素的种类是解题的关键,注意把握元素周期律的递变规律.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
16.水资源的利用、开发、保护直接关系到人类的生存和国民经济的发展.
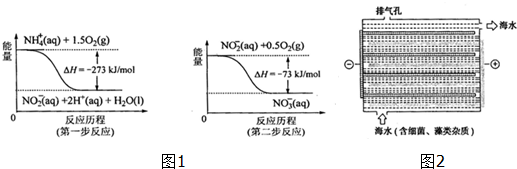
Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理.
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.

Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
17.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1CH3COOH与0.1mol•L-1氨水等体积混合(PH=7):c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(PH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1mol•L-1CH3COONa与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1 NaHCO3溶液等体积混合:c(HCO3-)>0.05mol•L-1>c(CO32-)>c(OH-) |
9.下列说法不正确的是( )
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
16.如图所示的电化学装置,电解质溶液为Na2SO4,下列说法不正确的是( )


| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
6.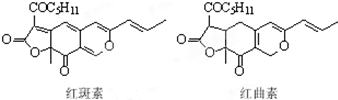 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )| A. | 红斑素和红曲素互为同分异构体 | |
| B. | 一定条件下红斑素和红曲素都能发生加聚和缩聚反应 | |
| C. | 红斑素中含有醚键、羰基、酯键这三种含氧官能团 | |
| D. | 1 mol红曲素最多能与6 mol H2发生加成反应 |
13.下列措施,一定能使NaCl溶液中c(OH-)减小的是( )
| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
10. 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断不正确的是( )| A. | a、b、c三点溶液的Kw相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
11.下列关于各实验装置图的叙述中正确的是( )
| A. | 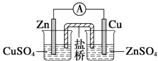 装置:构成锌-铜原电池 | |
| B. |  装置:实验室制氨气并收集干燥的氨气 | |
| C. | 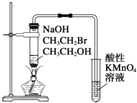 装置:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 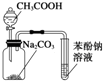 装置:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |