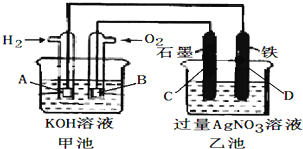
题目内容
13.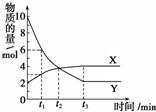 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为4X?Y | |
| B. | t2时,正反应速率等于逆反应速率 | |
| C. | t3时,Y浓度不再变化,反应达到平衡 | |
| D. | 当t1=2时,用X表示该反应在2 min内的平均反应速率为0.25mol/(L•min) |
分析 达到平衡时,Y的物质的量为2mol,变化量为10mol-2mol=8mol,X的物质的量为4mol,变化量为4mol-2mol=2mol,反应的方程式为4Y?X,结合图象解答该题.
解答 解:A.达到平衡时,Y的物质的量为2mol,变化量为10mol-2mol=8mol,X的物质的量为4mol,变化量为4mol-2mol=2mol,反应的方程式为4Y?X,故A错误;
B.t2时,没有达到平衡状态,则正逆反应速率不等,故B错误;
C.t3时,XY的物质的量不在变化,XY的浓度不再变化,达到平衡状态,故C正确;
D.当t1=2时,X的变化量为3mol-2mol=1mol,则v=$\frac{1mol}{2L•2min}$=0.25mol/(L•min),故D正确.
故选CD.
点评 本题考查化学平衡与图象问题的考查,侧重于学生的分析能力的考查,为高考常见题型,难度中等,注意把握图象曲线变化的趋势以及平衡状态的判断.

练习册系列答案
相关题目
1.现有X、Y、Z、W四种无色溶液,分别是HCl、Ba(NO3)2、Na2CO3、AgNO3中的一种.两两之间相互反应的现象(沉淀↓、气体↑)如表所示:试判断溶液X、Y、Z、W依次是( )
| X | Y | Z | W | |
| Y | ↑ | - | ↓ | 无明显现象 |
| Z | ↓ | ↓ | - | 无明显现象 |
| A. | HCl、Na2CO3、AgNO3、Ba(NO3)2 | B. | Na2CO3、HCl、Ba(NO3)2、AgNO3 | ||
| C. | Na2CO3、HCl、AgNO3、Ba(NO3)2 | D. | AgNO3、Ba(NO3)2、HCl、Na2CO3 |
8.下面是元素周期表的一部分.下列与表中元素有关的叙述正确的是( )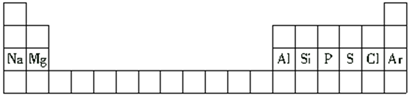

| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
18.下列各种方法中,适用于炼制相应金属的是( )
| A. | 加热氧化铜炼铜 | B. | 氧化镁跟铝粉共热炼镁 | ||
| C. | 用焦炭还原氧化铜炼铜 | D. | 电解熔融氯化钠冶炼钠 |
2.以下说法正确的是( )
| A. | 金属钠着火时可以用泡沫灭火器灭火 | |
| B. | 氯气可用于自来水的消毒 | |
| C. | 钠比铜活泼,因而钠可以从CuCl2溶液中置换出铜 | |
| D. | 氢氧化钠常用于治疗胃酸过多 |
3.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | Fe在足量Cl2中燃烧生成和FeCl2和FeCl3 |