题目内容
3.在恒温恒容条件下,向容积为2L的密闭容器中充人2mol SO2和2mol O2,已知:2SO2(g)+O2(g)?2SO2(g);△H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25a kJ.下列判断正确的是( )| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
分析 A.2L的密闭容器中充人2mol SO2,硫元素的物质的量浓度=$\frac{2mol}{2L}$=1mol/L,依据元素守恒解答即可;
B.2min达到平衡状态,反应放热0.25a kJ,说明二氧化硫反应的物质的量为0.5mol,据此解答即可;
C.充入三氧化硫,三氧化硫的含量增多,据此解答即可;
D.起始时向反应容器中充入2mol SO3,相当于初始加入2mol SO2和1mol O2,据此解答即可.
解答 解:A.2L的密闭容器中充人2mol SO2,硫元素的物质的量浓度=$\frac{2mol}{2L}$=1mol/L,反应至任何时刻都有S元素守恒,即:c(SO3)+c(SO2)=1.0mol/L,故A正确;
B.2min达到平衡状态,反应放热0.25a kJ,故反应消耗的二氧化硫的物质的量=0.5mol,故速率=$\frac{\frac{0.5}{2}}{2}$mol/(L•min)=0.125mol/(L•min),故B错误;
C.再充入2mol SO3,达平衡时SO3%(质量分数)增大,故C错误;
D.起始时向反应容器中充入2mol SO3,相当于初始加入2mol SO2和1mol O2,与初始时加入2mol SO2和1mol O2,吸热应大于0.75a,故D错误,
故选A.
点评 本题考查化学平衡的计算,题目难度中等,解答本题的关键是根据浓度关系计算平衡时各物质的物质的量,本题有利于调动学生的学习兴趣和学习积极性,能够提高学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 标准状况下22.4 L的CCl4中含有NA个分子 | |
| B. | 1 mol Cl2溶于足量水中一定转移NA个电子 | |
| C. | 18 g 18O2和18O3中一共含有NA个18O原子 | |
| D. | 1 mol•L-1的NaOH溶液中共含有NA个Na+ |
8.下列摩尔质量的说法正确的是( )
| A. | 物质的摩尔质量就是1mol物质的质量 | |
| B. | 1mol水的质量、水的摩尔质量和水的相对分子质量在数值上都是18 | |
| C. | 各种物质的摩尔质量不可能相同 | |
| D. | 与物质的质量、物质的量多少无关,但与相对分子质量一样都是物质的基本属性 |
8.下面是元素周期表的一部分.下列与表中元素有关的叙述正确的是( )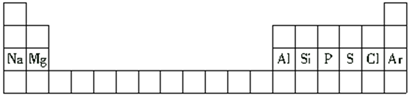

| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
12.关于同系物的下列叙述不正确的是( )
| A. | 一定属于同类物质 | B. | 分子内碳原子数一定不同 | ||
| C. | 分子组成一定满足同一通式 | D. | 可能互为同分异构体 |
13.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液:K-、Na+、Cu2+、OH- | |
| B. | 由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br+- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
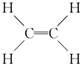 ,B中决定性质的重要官能团的名称为羟基.
,B中决定性质的重要官能团的名称为羟基.