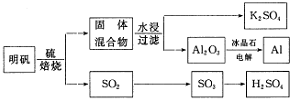
题目内容
3.世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯.二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定.②气体B能使湿润的红色石蕊试纸变蓝.
回答下列问题:
(1)电解时,发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑.实验室制备气体B的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②控制好反应温度.
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-.
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30min.
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是溶液蓝色变为无色,且30s内不变色;
②根据上述步骤可计算出原ClO2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g/L(用含字母的代数式表示).
分析 NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水;
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH;
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色褪去;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,据此计算V1 mL试样中ClO2的物质的量,进而计算100mL溶液中ClO2的物质的量,再结合m=nM计算原10mL溶液中ClO2的浓度.
解答 解:NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH,反应离子方程式为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
故答案为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色变为无色,且30s内不变色,说明反应到达终点,
故答案为:溶液蓝色变为无色,且30s内不变色;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{{100mL}_{\;}}{{V}_{1}mL}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{{100mL}_{\;}}{{V}_{1}mL}$×68.5g/mol,
浓度.
ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{{100mL}_{\;}}{{V}_{1}mL}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{{100mL}_{\;}}{{V}_{1}mL}$×67.5g/mol=cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g,即原溶液中ClO2的浓度为(cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g)÷0.01L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$.
点评 本题考查实验方案的设计,涉及对反应原理的考查、对反应条件的控制、氧化还原反应滴定应用等,注意根据题目信息可知反应条件,较好的考查学生分析问题、解决问题的能力,难度较大.

 优学名师名题系列答案
优学名师名题系列答案| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硫酸 |
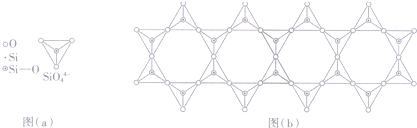
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
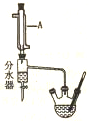 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)仪器A的名称冷凝管.
(2)反应时加热有利于提高的产率,但温度过高酯的产率反而降低,其可能的原因是温度过高时,正丁醇、乙酸易挥发,且副反应增加,导致酯产率降低.
(3)用分水器分出冷凝水的目的使用分水器分离出水,使平衡正向移动,提高反应产率,步骤I中判断反应终点的依据是分水器中的水层量不再增加.
II.乙酸正丁酯粗产品的精制:
(1)将三颈圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步骤作的目的是饱和Na2CO3溶液可溶解正丁醇,中和酸,从而除去产品中的杂质
(2)用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是有机层从分液漏斗上口倒入一个干燥的蒸馏烧瓶中.
(3)将酯层进行蒸馏.蒸馏手机乙酸正丁酯产品时,应将温度控制在126.1℃左右.
III.计算产率:称量制得的乙酸正丁酯的质量为12.76g,则乙酸正丁酯的产率为55%.
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
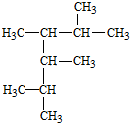 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷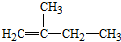 2-甲基-1-丁烯
2-甲基-1-丁烯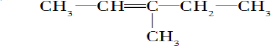 .
. .
.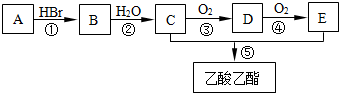
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.