题目内容
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
分析 X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,可推知Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:X、Y、Z均是短周期元素,X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,可推知Y为Na元素,Z为F元素,X、Y同周期,则X为S元素.
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,故A错误;
B.Na为金属元素,单质表现还原性,F、S为非金属,单质可以表现氧化性,非金属性S<F,故单质氧化性S<F2,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->F->Na+,故C错误;
D.X、Y、Z原子序数分别为16、11、9,原子序数:X>Y>Z,故D正确,
故选D.
点评 本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,题目难度不大,关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
相关题目
20.下列是各物质的相对分子质量,其中可能为同系物的是( )
| A. | 16 44 86 | B. | 16 28 58 | C. | 24 38 68 | D. | 24 32 56 |
7.在 2L密闭容器中发生反应N2+3H2?2NH3,经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )
| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
1.一定温度下,下列溶液的离子溶液关系式或pH正确的是( )
| A. | 浓度均为0.1mol/L的HCN溶液和NaCN溶液等体积混合后溶液呈碱性c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+) | |
| B. | pH=a的醋酸溶液,稀释100倍后,其pH=b,则a+2<b | |
| C. | c(NH4+)相同的①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中pH:④>②>①>③ | |
| D. | pH=5的H2S溶液中:c(HS-)<c(H+)=1×10-5mol/L |
2.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At2)为有色固体;HAt不稳定;AgAt不溶于水也不溶于稀酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是比H2S稳定的气体 |
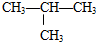 ⑤
⑤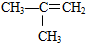

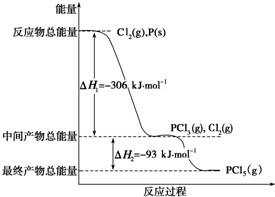 已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).