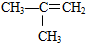题目内容
19.过量铝与一定量稀硫酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是 ( )| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硫酸 |
分析 过量铝与少量稀硫酸反应,为了加快反应速率,可以升高温度、增大铝固体的表面积或形成原电池反应,不影响生成氢气的总量,所加入物质不能改变氢离子的总物质的量,以此解答该题.
解答 解:A、升温,活化分子数目增多,反应速率加快,故A正确;
B、加水稀释,氢离子浓度降低,反应速率减慢,故B错误;
C、加入少量硫酸铜溶液,能够形成铝铜原电池,加快反应速率,氢离子物质的量不变,生成氢气总量不变,故C正确;
D、加入硫酸,氢离子物质的量增大,生成氢气总量增多,故D错误;
故选AC.
点评 本题考查化学反应速率的影响因素,题目难度不大,易错点为D,注意浓度较大的硫酸不一定是稀硫酸..

练习册系列答案
相关题目
9.L电子层最多可容纳的电子数为( )
| A. | 3个 | B. | 8个 | C. | 9个 | D. | 18个 |
10.下列说法正确的是( )
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
7.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得. 下列有关说法正确的是( )
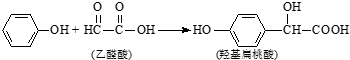
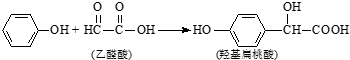
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |

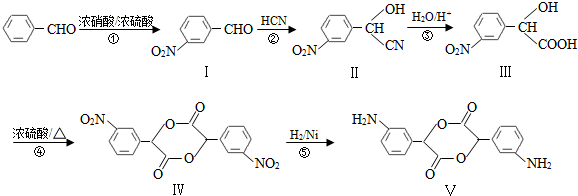
 ,和
,和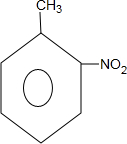 .
.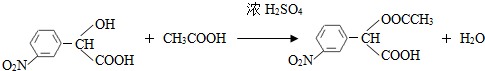 (要求写出反应条件),
(要求写出反应条件),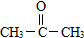 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为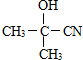 .
.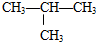 ⑤
⑤