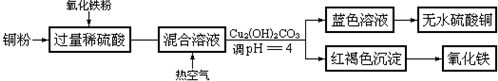
题目内容
13.有机物A可用作果实催熟剂.某同学欲以A为主要原料合成乙酸乙酯,其合成路线如图所示.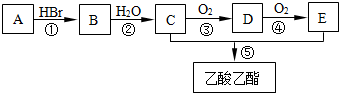
请回答:
(1)C分子中含有的官能团名称是羟基;C的同分异构体的核磁共振氢谱只有一种类型氢原子的吸收峰,其结构简式是CH3OCH3.
(2)反应①的反应类型是加成反应,反应 ②~⑤中反应类型相同的是②和⑤、③和④(填序号).
(3)由A可以直接转化为C,其反应的化学方程式是CH2=CH2+H2O $→_{△}^{催化剂}$CH3CH2OH.
(4)反应②的化学方程式是CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr,
反应③的化学方程式是2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
反应④的化学方程式是2CH3CHO+O2 $\stackrel{催化剂}{→}$2CH3COOH,
反应⑤的化学方程式是CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(5)为了检验B中的溴元素,以下操作合理的顺序是bcda(填序号).
a.加AgNO3溶液 b.加NaOH 溶液 c.加热 d.加稀硝酸至溶液显酸性.
分析 C连续氧化得到E,二者反应得到CH3COOCH2CH3,则C为CH3CH2OH,E为CH3COOH,乙醇发生氧化反应生成D为CH3CHO,乙醛进一步发生氧化反应生成CH3COOH,有机物A可用作果实催熟剂,系列转化得到CH3CH2OH,故A为C2H4,与水发生加成反应得到B为CH3CH2Br,溴乙烷发生水解反应得到CH3CH2OH,据此解答.
解答 解:C连续氧化得到E,二者反应得到CH3COOCH2CH3,则C为CH3CH2OH,E为CH3COOH,乙醇发生氧化反应生成D为CH3CHO,乙醛进一步发生氧化反应生成CH3COOH,有机物A可用作果实催熟剂,系列转化得到CH3CH2OH,故A为C2H4,与水发生加成反应得到B为CH3CH2Br,溴乙烷发生水解反应得到CH3CH2OH,
(1)C为CH3CH2OH,C分子中含有的官能团名称是羟基,C的同分异构体的核磁共振氢谱只有一种类型氢原子的吸收峰,其结构简式是CH3OCH3,
故答案为:羟基;CH3OCH3;
(2)反应①是乙烯与HBr发生加成反应,反应②⑤均属于取代反应,反应③④均是氧化反应,
故答案为:加成;②⑤;③④;
(3)由A直接转化为C的化学方程式是 CH2=CH2+H2O $→_{△}^{催化剂}$CH3CH2OH,
故答案为:CH2=CH2+H2O $→_{△}^{催化剂}$CH3CH2OH;
(4)反应②的化学方程式是CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr,
反应③的化学方程式是 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
反应④的化学方程式是 2CH3CHO+O2 $\stackrel{催化剂}{→}$2CH3COOH,
反应⑤的化学方程式是 CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr;2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;2CH3CHO+O2 $\stackrel{催化剂}{→}$2CH3COOH;CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(5)检验B中的溴元素,可以将B在碱性条件下水解,再酸化后加AgNO3溶液,若出现淡黄色沉淀,则有溴元素,所以操作的顺序是bcda,
故答案为:bcda.
点评 本题考查有机物推断,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 浓度均为0.1mol/L的HCN溶液和NaCN溶液等体积混合后溶液呈碱性c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+) | |
| B. | pH=a的醋酸溶液,稀释100倍后,其pH=b,则a+2<b | |
| C. | c(NH4+)相同的①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中pH:④>②>①>③ | |
| D. | pH=5的H2S溶液中:c(HS-)<c(H+)=1×10-5mol/L |
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 C>D>A>B |
| A. | 环己二烯在脱氢催化剂作用下转变为苯和氢气 | |
| B. | 溴乙烷在NaOH的乙醇溶液中的反应 | |
| C. | 乙酸和乙醇在浓硫酸的作用下生成乙酸乙酯和水 | |
| D. | 乙醛能将新制的Cu(OH)2还原成Cu2O |
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At2)为有色固体;HAt不稳定;AgAt不溶于水也不溶于稀酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是比H2S稳定的气体 |
| A. | 苯在一定条件下可与液溴发生取代反应 | |
| B. | 苯分子内存在碳碳双键 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯不溶于水且密度大于水 |