题目内容
13.如图为元素周期表的一部分,a、b、c…为元素周期表中前4周期的部分元素.回答下列问题:
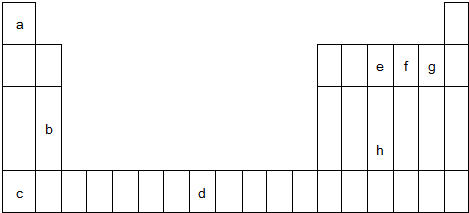
(1)d3+的未成对电子数为5 个;
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序F>N>O(写元素符号)
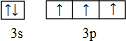
(3)请写出h元素原子价电子轨道表示式
 ;
;(4)ea3分子的电子式是
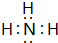 ,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
分析 由元素在周期表中位置,可知a为H,b为Mg,c为K,d为Fe,e为N,f为O,g为F,h为P.
(1)Fe3+的核外电子排布为1s22s22p63s23p63d5;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)P元素原子核外电子排布为1s22s22p63s23p3;
(4)NH3分子中N原子与H原子之间形成1对共用电子对,为三角锥形结构,N原子形成3个N-H键,含有1对孤对电子,杂化轨道数目为4.
解答 解:由元素在周期表中位置,可知a为H,b为Mg,c为K,d为Fe,e为N,f为O,g为F,h为P.
(1)Fe3+的核外电子排布为1s22s22p63s23p63d5,3d轨道5个电子为单电子,故答案为:5;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能F>N>O,故答案为:F>N>O;
(3)P元素原子核外电子排布为1s22s22p63s23p3,价电子轨道表示式为 ,故答案为:
,故答案为: ;
;
(4)NH3分子中N原子与H原子之间形成1对共用电子对,电子式为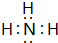 ,为三角锥形结构,N原子形成3个N-H键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,
,为三角锥形结构,N原子形成3个N-H键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,
故答案为: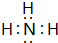 ;三角锥形;sp3.
;三角锥形;sp3.
点评 本题是对物质结构的考查,涉及元素周期表、核外电子排布、电离能、电子式、分子构型判断、杂化发生判断,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列叙述正确的是( )
| A. | 向BaCl2溶液中通入SO2气体,先有白色沉淀,后沉淀消失 | |
| B. | CCl4和NH3两分子中各原子最外层均满足8电子结构 | |
| C. | 若短周期元素R2+和M+的电子层结构相同,则金属性R>M | |
| D. | 标准状况下,11.2 LN2和O2的混合气所含原子总数约为6.02×1023 |
4.下列试剂,必须用棕色瓶盛装的是( )
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银.
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银.
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑥ |
1.下列有关卤族元素的叙述不正确的是( )
| A. | 卤族元素从F到I,其气态氢化物的稳定性逐渐减弱,HX水溶液酸性逐渐增强 | |
| B. | 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX的熔沸点:HF>HI>HBr>HCl | |
| D. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
8.下列物质中,含极性键和非极性键且分子有极性的是( )
| A. | 乙烯 | B. | H2O2 | C. | 甲烷 | D. | 三氯甲烷 |
5.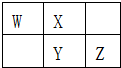 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | W元素形成的单核阴离子半径小于X元素形成的单核阴离子半径 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
 ;
;