题目内容
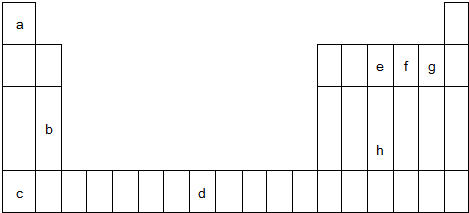
5.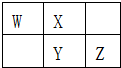 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | W元素形成的单核阴离子半径小于X元素形成的单核阴离子半径 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 W、X、Y、Z四种短周期元素,W的气态氢化物可使湿润的红色石蕊试纸变蓝,则W是N元素,由元素在周期表中的物质可知,X为氧元素、Y为硫元素、Z为氯元素,据此解答.
解答 解:W、X、Y、Z四种短周期元素,W的气态氢化物可使湿润的红色石蕊试纸变蓝,则W是N元素,由元素在周期表中的物质可知,X为氧元素、Y为硫元素、Z为氯元素.
A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;
B.只有氯元素的最高价含氧酸才一定比Y的含氧酸酸性强,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径N3->O2-,故C错误;
D.Cl2与水的反应中既表现氧化性,也表现了还原性,故D错误;
故选A.
点评 本题考查位置结构性质关系、元素周期律等,难度不大,推断元素是解题的关键,注意整体把握元素周期表的结构,W的推断是突破口.

练习册系列答案
相关题目
20.已知25℃、101kPa条件下,H2、CO、CH4的燃烧分别为286kJ•mol-1、283kJ•mol-1、890kJ•mol-1,若将a mol H2、CO、CH4的混合气体完全燃烧,生成气态CO2和液态H2O,且n(CO2)=n(H2O),则放出的热量(Q)可能为( )
| A. | 284.5a kJ | B. | 586.5a kJ | C. | 555a kJ | D. | 598a kJ |
17.下面三种方法都可以制得氯气.
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>MnO2>KMnO4 |
14.下列关于微粒之间作用力的说法正确的是( )
| A. | 在分子中,化学键可能只有π键,而没有σ 键 | |
| B. | 不同元素组成的多原子分子里的化学键一定都是极性键 | |
| C. | 实验测得NO2和CH3COOH 的摩尔质量均比理论值大,可能原因是在实验条件下这两种分子均能发生“双聚”,这种分子“双聚”的作用力是相同类型的作用力 | |
| D. | 原子晶体的熔点一定比分子晶体高,原因之一是共价键是一种比分子间作用力更为强烈的相互作用 |
 ,
, .
.
 ;
;



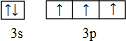 ;
;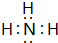 ,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3. .
.