题目内容
8.下列物质中,含极性键和非极性键且分子有极性的是( )| A. | 乙烯 | B. | H2O2 | C. | 甲烷 | D. | 三氯甲烷 |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,这样的分子为极性分子;分子中正负电荷的重心重合,则为非极性分子,以此解答该题.
解答 解:A.乙烯(C2H4)中有C、H元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故A不选;
B.H2O2含有O-H键,为极性键,O-O为非极性键,结构不对称,为极性分子,故B选;
C.甲烷不含非极性键,故C不选;
D.三氯甲烷为极性分子,不含非极性键,故D不选.
故选B.
点评 本题考查了共价键的类型、共价键与分子的极性的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答.

练习册系列答案
相关题目
19.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | F、Cl、Br氢化物的沸点依次升高 | D. | P、S、Cl最高正价依次升高 |
20.已知25℃、101kPa条件下,H2、CO、CH4的燃烧分别为286kJ•mol-1、283kJ•mol-1、890kJ•mol-1,若将a mol H2、CO、CH4的混合气体完全燃烧,生成气态CO2和液态H2O,且n(CO2)=n(H2O),则放出的热量(Q)可能为( )
| A. | 284.5a kJ | B. | 586.5a kJ | C. | 555a kJ | D. | 598a kJ |
17.下面三种方法都可以制得氯气.
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>MnO2>KMnO4 |
2.下列反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2OA1O2═+4NH4++2H2O | |
| B. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | 浓盐酸与铁屑反应:Fe+2H+═Fe2++H2↑ |


 ;
;



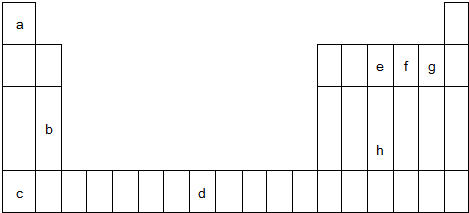
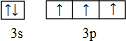 ;
;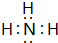 ,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.