题目内容
3.下列叙述正确的是( )| A. | 向BaCl2溶液中通入SO2气体,先有白色沉淀,后沉淀消失 | |
| B. | CCl4和NH3两分子中各原子最外层均满足8电子结构 | |
| C. | 若短周期元素R2+和M+的电子层结构相同,则金属性R>M | |
| D. | 标准状况下,11.2 LN2和O2的混合气所含原子总数约为6.02×1023 |
分析 A.BaCl2溶液中通入SO2气体不反应;
B.NH3分子中H原子最外层为2电子结构;
C.若短周期元素R2+和M+的电子层结构相同,则R和M为同一周期,且M为第IA族,R为第IIA族;
D.标准状况下,11.2LN2和O2的混合气体的物质的量为11.2L÷22.4L/mol=0.5mol,则分子数、原子数可求.
解答 解:A.因为盐酸酸性比亚硫酸强,所以BaCl2溶液中通入SO2气体不会生成亚硫酸钡和氯化氢,故A错误;
B.CCl4分子中各原子最外层均满足8电子结构,而NH3分子中H原子最外层为2电子结构,故B错误;
C.若短周期元素R2+和M+的电子层结构相同,则R和M为同一周期,且M为第IA族,R为第IIA族,则金属性R<M,故C错误;
D.标准状况下,11.2LN2和O2的混合气体的物质的量为11.2L÷22.4L/mol=0.5mol,则分子数为:3.01×1023,又因为是双原子分子,则原子数为:6.02×1023,故D正确;
故选D.
点评 本题考查了物质之间的反应判断,原子结构和离子结构,物质的量的求算等,难度不大,抓住基础是关键.

练习册系列答案
相关题目
13.下列说法正确的是( )
①淀粉、纤维素、油脂、蛋白质都是天然有机高分子化合物
②淀粉、纤维素、蔗糖都是非还原性糖
③三大营养素糖类、油脂、蛋白质中,油脂是热能最高的营养素
④用纯碱(Na2CO3)热溶液洗涤餐具上的油污
⑤氯水使红墨水褪色原理和CH2=CH2使Br2的CCl4溶液褪色原理相同
⑥现用清洁燃料主要有压缩天然气和液化石油气两类,它们均属于碳氢化合物.
①淀粉、纤维素、油脂、蛋白质都是天然有机高分子化合物
②淀粉、纤维素、蔗糖都是非还原性糖
③三大营养素糖类、油脂、蛋白质中,油脂是热能最高的营养素
④用纯碱(Na2CO3)热溶液洗涤餐具上的油污
⑤氯水使红墨水褪色原理和CH2=CH2使Br2的CCl4溶液褪色原理相同
⑥现用清洁燃料主要有压缩天然气和液化石油气两类,它们均属于碳氢化合物.
| A. | ①②③ | B. | ②③④⑥ | C. | ②④⑤⑥ | D. | ③④⑤ |
11.在一定的温度下,一定量的水中,Ca(OH)2悬浊液中存在如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),当向混合物中加入少量CaO粉末时,下列说法正确的是( )
| A. | Ca2+数目减少 | B. | Ca2+浓度增大 | ||
| C. | 溶液的pH增大 | D. | Ca(OH)2固体质量不变 |
12.下列叙述中,不正确的是( )
| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |

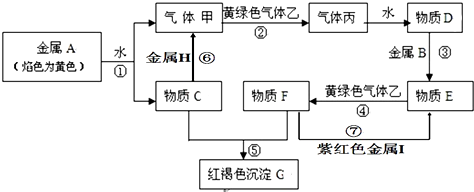

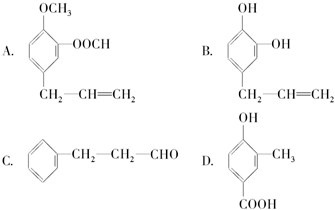
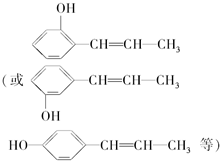 ,
,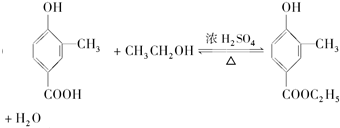 .
.
 ;
;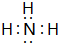 ,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.