题目内容
7.某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀CuI.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.已知:I2+2S2O32-═S4O62-+2I-①可选用淀粉溶液作滴定指示剂,滴定终点的现象是滴入最后一滴Na2S2O3溶液,溶液蓝色褪去,且半分钟内不变色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
分析 ①向含碘的溶液中加入淀粉溶液,溶液变蓝色,再向溶液中加入Na2S2O3溶液,由于碘被Na2S2O3还原为碘离子,溶液蓝色逐渐褪去,当溶液蓝色刚好消失时,碘正好完全反应,从而进行滴定终点的判定;
②CuCl2溶液与KI溶液相遇时,发生氧化还原反应,+2价的铜离子得电子,变为+1价,-1碘离子失电子变为0价,离子反应中遵循电子、电荷守恒;
③根据电子转移守恒及I2+2S2O32-═S4O62-+2I-,可得关系式:2Cu2+~I2~2Na2S2O3 ,则n(CuCl2•2H2O)=n(Na2S2O3),根据m=nM计算CuCl2•2H2O的质量,进而计算CuCl2•2H2O的质量百分数.
解答 解:①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉,滴入最后一滴Na2S2O3溶液,溶液蓝色褪去,且半分钟内不变色,说明滴定到达终点,
故答案为:淀粉溶液;滴入最后一滴Na2S2O3溶液,溶液蓝色褪去,且半分钟内不变色;
②CuCl2溶液与KI溶液相遇时,发生氧化还原反应,+2价的铜离子得电子,变为+1价,-1碘离子失电子变为0价,由电子、电荷守恒可知离子反应为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
③由2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-═2CuI↓+I2,可得关系式:2Cu2+~I2~2Na2S2O3 ,则n(CuCl2•2H2O)=n(Na2S2O3)=0.1000mol/L×0.0200L=0.002mol,故m(CuCl2•2H2O)=0.002mol×171g/mol=0.342g,所以试样中CuCl2•2H2O的质量百分数为$\frac{0.342g}{0.36g}$100%=95%,
故答案为:95%.
点评 本题考查氧化还原反应滴定计算,明确滴定过程的反应原理是解本题的关键,注意利用关系式计算.

| A. | 在分子中,化学键可能只有π键,而没有σ 键 | |
| B. | 不同元素组成的多原子分子里的化学键一定都是极性键 | |
| C. | 实验测得NO2和CH3COOH 的摩尔质量均比理论值大,可能原因是在实验条件下这两种分子均能发生“双聚”,这种分子“双聚”的作用力是相同类型的作用力 | |
| D. | 原子晶体的熔点一定比分子晶体高,原因之一是共价键是一种比分子间作用力更为强烈的相互作用 |
| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2OA1O2═+4NH4++2H2O | |
| B. | 少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑ | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | 浓盐酸与铁屑反应:Fe+2H+═Fe2++H2↑ |
| A. | 两种阳离子 | B. | 一种单质和一种化合物分子 | ||
| C. | 一种分子和一种离子 | D. | 一种原子和一种分子 |
| A. | 某个氯原子的质量为ag,则氯元素的相对原子质量一定是aNA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 标准状况下,11.2LCCl4所含的原子总数为2.5NA | |
| D. | 10mL98%的浓H2SO4用水稀释至100mL,H2SO4的质量分数为9.8% |

 ;
;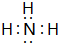 ,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.
,其分子的空间构型是三角锥形,分子中e原子的杂化类型是sp3.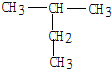 2-甲基丁烷;(2)
2-甲基丁烷;(2)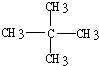 2,2-二甲基丙烷.
2,2-二甲基丙烷. .
.
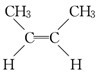 (顺式2-丁烯)、
(顺式2-丁烯)、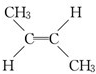 (反式2-丁烯);
(反式2-丁烯); ,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式
,B.可与足量H2加成得到2-甲基戊烷,请写出B的结构简式CH3CH=CHC(CH3)=CHCH3;写出B发生加聚反应的方程式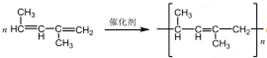 .
.