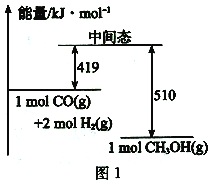
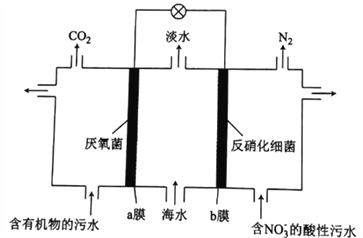
题目内容
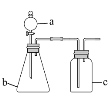
【题目】用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 |
|
B | 浓 HNO3 | Cu片 | KI--淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 稀硫酸 | FeS | 酸性KMnO4溶液 | 验证H2S具有还原性 |
A.AB.BC.CD.D
【答案】D
【解析】
A.浓盐酸与二氧化锰反应需要加热;
B.浓硝酸与Cu反应生成二氧化氮,二氧化氮可氧化KI生成碘;
C.碳酸氢根离子与硫酸反应生成二氧化碳;
D.生成的二氧化硫能被高锰酸钾氧化。
A. 浓盐酸与MnO2反应制取Cl2需要在加热条件下进行,反应装置缺少加热装置,无法完成实验,不能制取氯气,A错误;
B. 浓硝酸与铜反应生成硝酸铜、二氧化氮和水,二氧化氮具有氧化性,遇KI-淀粉溶液使溶液变蓝,NO2溶于水,反应产生的HNO3具有强氧化性,也能使KI-淀粉溶液变蓝色,不能实现实验目的,B错误;
C. 若溶液X中含有碳酸氢根离子或亚硫酸氢根离子或亚硫酸根离子均能达到相同现象,故无法实现实验目的,C错误;
D. FeS与稀硫酸反应产生H2S气体,该气体具有还原性,可以被酸性KMnO4溶液氧化而使溶液褪色,因此图中实验能证明二氧化硫具有还原性,D正确;
故合理选项是D。

 计算高手系列答案
计算高手系列答案【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,11℃时液化成红棕色液体。
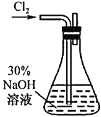
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

①冰水浴的作用是____________。
②NaOH溶液的主要作用为吸收反应产生的Cl2,其吸收液可用于制取漂白液,该吸收反应的氧化剂与还原剂之比为___________________。
③以NaClO3和HCl为原料制备ClO2的化学方程式为_________________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到________,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生Cl-,其含量一般控制在0.3-0.5 mg·L1,某研究小组用下列实验方案测定长期不放水的自来水管中Cl-的含量:量取10.00 mL的自来水于锥形瓶中,以K2CrO4为指示剂,用0.0001mol·L-1的AgNO3标准溶液滴定至终点。重复上述操作三次,测得数据如下表所示:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液的体积/mL | 10.24 | 10.02 | 9.98 | 10.00 |
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作_____________。
②测得自来水中Cl-的含量为______ mg·L1。
③若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_______(填“偏高”、“偏低”或“无影响”)。