题目内容
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:C(S) + H2O(g)![]() CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
CO(g) + H2(g) △H = + 131.3 kJ·mol-1一定温度下,在一个容积可变的容器中,发生上述反应,能确定该反应达到化学平衡状态的是_______________ (填标号)。
A.容器中的压强不变
B.1mol H—H键断裂的同时断裂2mol H—O键
C.v正(H2O) = v逆(H2O)
D.c(CO) = c(H2)
(2)一定条件下,利用CO与H2。反应可制得甲醇:CO(g) +2H2(g) ![]() CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
CH3OH (g)图1表示该反应进行过程中的能量变化,图2表示一定温度下,在体积为2L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH的浓度随时间变化情况。
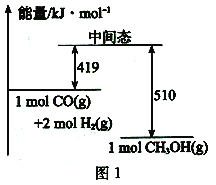
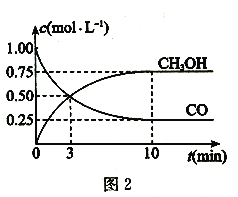
①根据图l,写出在该条件下CO制备甲醇气体的热化学方程式:___________。
②根据图2,计算该温度下反应CO(g) + 2H2(g) ![]() CH3OH (g)的平衡常数为____。
CH3OH (g)的平衡常数为____。
③以甲醇为燃料的新型燃料电池,正极通入O2,负极通入CH3OH,在KOH溶液中CH3OH与O2作用生成H2O和K2CO3 。 写出正极的电极反应式____________;放电时,OH-移向电池的_________(填“正”或“负")极。
(3)氯化铵溶液因NH4+离子水解使溶液呈______性,要使氯化铵溶液变为中性又不引入新杂质应选用_________(填“盐酸”或“氨水"或“氢氧化钠")。
(4)现有25℃时,pH=13的Ba(OH )2溶液。求:
① 该Ba(OH)2溶液中OH-的物质的量浓度为_____________________。
② 该Ba(OH)2溶液的物质的量浓度为_____________________。
(5)用惰性电极电解Cu(NO3)2溶液时,如果阴极上有1.92g铜析出,则阳极上产生气体的体积(标准状况下)约为____________L。
【答案】B C CO(g) + 2H2(g) ![]() CH3OH (g) △H1 =91 kJ·mol-1 12 O2 + 2H2O + 4e-= 4 OH- 负 酸 氨水 1×10-1mol·L-1或 0.1mol·L-1 5×10-2mol·L-1或 0.05mol·L-1 0.336
CH3OH (g) △H1 =91 kJ·mol-1 12 O2 + 2H2O + 4e-= 4 OH- 负 酸 氨水 1×10-1mol·L-1或 0.1mol·L-1 5×10-2mol·L-1或 0.05mol·L-1 0.336
【解析】
(1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断;
(2)①依据图象1结合热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
②计算出平衡时各物质的平衡浓度,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可求得平衡常数;
③正极氧气得电子,原电池放电时OH-移向负极;
(3)根据铵根离子水解方程式回答;
(4)pH=13的Ba(OH)2溶液中c(OH-)=![]() mol·L-1=0.1mol·L-1,
mol·L-1=0.1mol·L-1,
根据原子守恒得c[Ba(OH)2]=![]() c(OH-);
c(OH-);
(1)C(s)+H2O(g)![]() CO(g)+H2(g)△H=+131.3kJ?mol-1,反应是气体体积增大的吸热反应,
CO(g)+H2(g)△H=+131.3kJ?mol-1,反应是气体体积增大的吸热反应,
a.一定温度下,在一个容积可变的密闭容器中发生上述反应,反应前后气体的物质的量发生变化,随反应进行气体的物质的量增加,压强增大,保持恒压,容器中的压强始终不变,不能说明反应到达平衡,故a错误;
b.1 molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故b正确.
c.反应速率之比等于化学方程式计量数之比,v正(CO)=v逆(H2O),说明水的正反应速率和逆反应速率相同,反应达到平衡状态,故c正确;
d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故d错误;
故选bc;
(2)①根据上图1在该条件下CO制备甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-91KJ·mol-1;
②根据平衡时CO的浓度为0.25mol·L-1可知,反应消耗的H2物质的量为2×2L×0.75mol·L-1=3mol,则平衡时H2的物质的量浓度为0.5mol·L-1,甲醇平衡浓度=0.75mol·L-1,根据平衡常数等于生成的浓度幂之积除以反应物的浓度幂之积可得,K=![]() =12L2·mol-2;
=12L2·mol-2;
③以甲醇为燃料的新型燃料电池,正极通入O2,负极通入CH3OH,在KOH溶液中CH3OH与O2作用生成H2O和K2CO3 。 正极的电极反应式O2 + 2H2O + 4e-= 4 OH-;放电时,OH-移向电池的负极。
(3)氯化铵溶液因NH4+离子水解,NH4++H2O![]() NH3·H2O+H+,使溶液呈酸性,要使氯化铵溶液变为中性又不引入新杂质应选用氨水。
NH3·H2O+H+,使溶液呈酸性,要使氯化铵溶液变为中性又不引入新杂质应选用氨水。
(4)①pH=13的Ba(OH)2溶液中c(OH-)=![]() mol·L-1=0.1mol·L-1,
mol·L-1=0.1mol·L-1,
②根据原子守恒得c[Ba(OH)2]=![]() c(OH-)=0.05ol·L-1,;
c(OH-)=0.05ol·L-1,;
(5)根据2Cu(NO3)2+2H2O=2Cu+O2↑+4HNO3,得关系式:
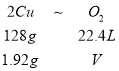
V=0.336L。

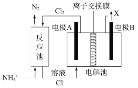
【题目】次磷酸钠![]() 是有机合成的常用还原剂,一般制备方法是将黄磷
是有机合成的常用还原剂,一般制备方法是将黄磷![]() 和过量烧碱溶液混合、加热,生成次磷酸钠和
和过量烧碱溶液混合、加热,生成次磷酸钠和![]() 。
。![]() 是一种无色、有毒的可燃性气体。实验装置如图所示:
是一种无色、有毒的可燃性气体。实验装置如图所示:
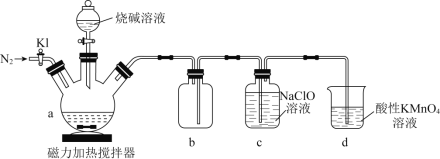
回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开![]() ,通入
,通入![]() 一段时间,关闭
一段时间,关闭![]() ,打开磁力加热搅拌器,滴加烧碱溶液。
,打开磁力加热搅拌器,滴加烧碱溶液。
①活性炭粉末作为黄磷的分散剂,原理是_______;b的作用______________。
②![]() 中反应的化学方程式为_______________________________。
中反应的化学方程式为_______________________________。
(2)反应结束后,打开![]() ,继续通入
,继续通入![]() ,目的是______________________________。d的作用是__________________。
,目的是______________________________。d的作用是__________________。
(3)![]() 中生成
中生成![]() 和NaCl,相关物质溶解度
和NaCl,相关物质溶解度![]() 如下:
如下:
|
| |
NaCl | 37 | 39 |
| 100 | 667 |
充分反应后,将c中混合液蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为_____________,然后________________、______________、过滤、洗涤、干燥,得到含![]() 的粗产品。
的粗产品。
(4)产品纯度测定:
取产品m克配成![]() 溶液,取25mL于锥形瓶中,酸化后加入
溶液,取25mL于锥形瓶中,酸化后加入![]() 碘水,于暗处充分反应后,以淀粉溶液做指示剂,用
碘水,于暗处充分反应后,以淀粉溶液做指示剂,用![]() 溶液滴定至终点,平均消耗VmL。相关反应方程式为:
溶液滴定至终点,平均消耗VmL。相关反应方程式为:![]() ,
,![]() 。产品纯度表达式为________________。
。产品纯度表达式为________________。
【题目】由下列“实验操作和现象”与“结论”均正确的( )
选项 | 实验操作及现象 | 结论 |
A | 将含铁的氧化物的砖块用盐酸浸取,浸取液能使KMnO4溶液褪色 | 浸取液中含Fe2+ |
B | 常温下,测得饱和Na2CO3 溶液的pH大于饱和NaHCO3 溶液的pH | 常温下水解程度 |
C | 25℃时,向AgNO3溶液中滴加足量NaCl溶液至不再产生沉淀,然后滴加KI溶液,有黄色沉淀生成 | 25℃时,Ksp(AgCl)>Ksp(AgI) |
D | 将Cl2通入滴有酚酞的NaOH溶液后,溶液褪色 | Cl2具有漂白性 |
A.AB.BC.CD.D
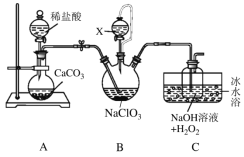
【题目】用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 |
|
B | 浓 HNO3 | Cu片 | KI--淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 稀硫酸 | FeS | 酸性KMnO4溶液 | 验证H2S具有还原性 |
A.AB.BC.CD.D