题目内容
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,11℃时液化成红棕色液体。
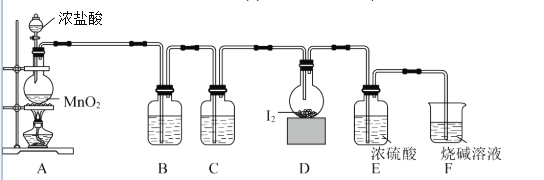
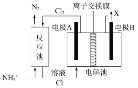
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。

①冰水浴的作用是____________。
②NaOH溶液的主要作用为吸收反应产生的Cl2,其吸收液可用于制取漂白液,该吸收反应的氧化剂与还原剂之比为___________________。
③以NaClO3和HCl为原料制备ClO2的化学方程式为_________________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到________,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生Cl-,其含量一般控制在0.3-0.5 mg·L1,某研究小组用下列实验方案测定长期不放水的自来水管中Cl-的含量:量取10.00 mL的自来水于锥形瓶中,以K2CrO4为指示剂,用0.0001mol·L-1的AgNO3标准溶液滴定至终点。重复上述操作三次,测得数据如下表所示:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液的体积/mL | 10.24 | 10.02 | 9.98 | 10.00 |
①在滴定管中装入AgNO3标准溶液的前一步,应进行的操作_____________。
②测得自来水中Cl-的含量为______ mg·L1。
③若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_______(填“偏高”、“偏低”或“无影响”)。
【答案】收集ClO2(或使ClO2冷凝为液体) 1:1 2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+2NaCl+2H2O 溶液分层,下层为紫红色 用AgNO3标准溶液进行润洗 3.55 偏低
【解析】
(1)①冰水浴可降低温度,防止挥发;
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠;
③以NaClO3和HCl为原料制备ClO2,同时有Cl2和NaCl生成,结合电子守恒和原子守恒写出发生反应的化学方程式;
(2)反应生成碘,碘易溶于四氯化碳,下层为紫色;
(3)根据滴定操作中消耗的AgNO3的物质的量计算溶液中含有的Cl-的物质的量,再计算浓度即可。
(1)①冰水浴可降低温度,防止挥发,可用于冷凝、收集ClO2;
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,此反应中Cl2既是氧化剂,又是还原剂,还原产物NaCl和氧化产物NaClO的物质的量之比为1:1,则该吸收反应的氧化剂与还原剂之比为1:1;
③以NaClO3和HCl为原料制备ClO2,同时有Cl2和NaCl生成,则发生反应的化学方程式为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+2NaCl+2H2O;
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄,说明生成碘,碘易溶于四氯化碳,即当观察到溶液分层,下层为紫红色时,说明有I2生成,体现ClO2具有氧化性;
(3)①装入AgNO3标准溶液,应避免浓度降低,应用AgNO3标准溶液进行润洗后再装入AgNO3标准溶液;
②滴定操作中第1次消耗AgNO3溶液的体积明显偏大,可舍去,取剩余3次数据计算平均体积为![]() mL=10.00mL,含有AgNO3的物质的量为0.0001mol·L-1×0.01L=1×10-6mol,测得自来水中Cl-的含量为
mL=10.00mL,含有AgNO3的物质的量为0.0001mol·L-1×0.01L=1×10-6mol,测得自来水中Cl-的含量为![]() =3.55g·L1;
=3.55g·L1;
③在滴定终点读取滴定管刻度时,俯视标准液液面,导致消耗标准液的体积读数偏小,则测定结果偏低。

【题目】由下列“实验操作和现象”与“结论”均正确的( )
选项 | 实验操作及现象 | 结论 |
A | 将含铁的氧化物的砖块用盐酸浸取,浸取液能使KMnO4溶液褪色 | 浸取液中含Fe2+ |
B | 常温下,测得饱和Na2CO3 溶液的pH大于饱和NaHCO3 溶液的pH | 常温下水解程度 |
C | 25℃时,向AgNO3溶液中滴加足量NaCl溶液至不再产生沉淀,然后滴加KI溶液,有黄色沉淀生成 | 25℃时,Ksp(AgCl)>Ksp(AgI) |
D | 将Cl2通入滴有酚酞的NaOH溶液后,溶液褪色 | Cl2具有漂白性 |
A.AB.BC.CD.D
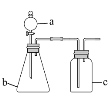
【题目】用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 |
|
B | 浓 HNO3 | Cu片 | KI--淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 稀硫酸 | FeS | 酸性KMnO4溶液 | 验证H2S具有还原性 |
A.AB.BC.CD.D