题目内容
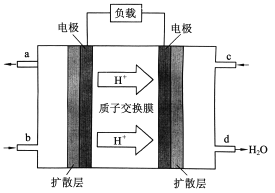
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
【答案】D
【解析】
A.阳离子移向正极,所以该电池工作时,b膜为阳离子交换膜,故A错误;B.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,则处理后的含NO3-污水的pH增大,故B错误;C.负极上有机物失电子发生氧化反应,电极反应式为C6H10O5+7H2O+24e-=6CO2↑+24H+,故C错误;D.阴离子移向负极,a膜为阴离子交换膜,所以导线中流过1mol电子,理论上有1mol Cl-通过a膜,所以D选项是正确的。

【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)H1=-53.7kJ/mol
CH3OH(g)+H2O(g)H1=-53.7kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+ H2O(g)H2
CO(g)+ H2O(g)H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知: ①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)![]() H2O(g) H3=+440kJ/mol
H2O(g) H3=+440kJ/mol
请回答(不考虑温度对H的影响):
(1)a.反应II的H2=____kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K的数值为_____。
CH3OH(g)的平衡常数K的数值为_____。
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂) ____。
(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____。
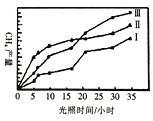
(4)利用光能和光催化剂,可將CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______和Li2O2-2e-=2Li++O2