题目内容
【题目】MnSO4H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
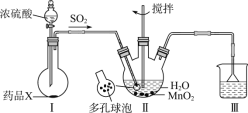
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
【答案】C
【解析】
由实验装置可知,X为亚硫酸钠,与浓硫酸反应生成二氧化硫,而Cu与浓硫酸常温下不反应;II中“多孔球泡”可增大SO2的吸收速率,二氧化硫与二氧化锰反应生成MnSO4,蒸发浓缩、冷却结晶可得到晶体,Ⅲ中NaOH溶液可吸收尾气,以此来解答。
A.Cu与浓硫酸反应制取SO2需要加热,装置图中无加热装置,所以X不可能为Cu;亚硫酸钠,与浓硫酸发生复分解反应生成硫酸钠、水、二氧化硫,所以装置I烧瓶中放入的药品X为Na2SO3,A正确;
B.装置Ⅱ中用“多孔球泡”,增大接触面积,可增大SO2的吸收速率,B正确;
C.SO2是有毒气体,不能随意排入大气,可根据SO2是酸性氧化物,能够与碱反应的性质除去,所以Ⅲ中NaOH溶液可吸收尾气,而饱和NaHSO3溶液不可吸收尾气,C错误;
D.用装置Ⅱ反应后的溶液为MnSO4,制备MnSO4H2O,通过蒸发结晶、过滤、洗涤及干燥可得到,D正确;
故合理选项是C。

 冲刺100分单元优化练考卷系列答案
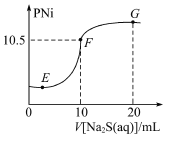
冲刺100分单元优化练考卷系列答案【题目】用如下图所示的装置进行实验(夹持仪器略去),其中a、b、c中分别盛有试剂1、2、3,能达到实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 |
|
B | 浓 HNO3 | Cu片 | KI--淀粉溶液 | 验证NO2的氧化性 | |
C | 稀硫酸 | 溶液X | 澄淸石灰水 | 验证X中是否有CO32- | |
D | 稀硫酸 | FeS | 酸性KMnO4溶液 | 验证H2S具有还原性 |
A.AB.BC.CD.D