题目内容
17.某元素的原子核外有三个电子层,其中M电子数是L层电子数的一半,则此元素( )| A. | C | B. | Si | C. | S | D. | C1 |
分析 本题根据元素的核外电子排布,三个电子层分别为K、L、M,K层为2个电子,L层为8个电子,M层的电子数是L层电子数的一半,可以得到M层为4个电子,该原子的核外电子数就可以判断出来.
解答 解:三个电子层即为K、L、M,K层为2个电子,L层为8个电子,M层的电子数是L层电子数的一半,M层为4个电子,一共14个电子,该原子为硅,故选B.
点评 本题考查元素的核外电子排布规律,根据核外电子排布规律结合题意确定核外电子数,进而确定元素的名称.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
7.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )
| A. | 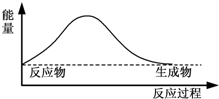 | B. | 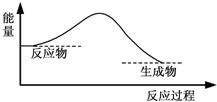 | ||
| C. | 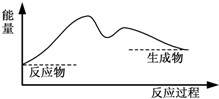 | D. | 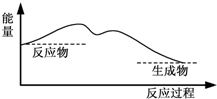 |
5.下列事实中能证明某化合物中一定是离子化合物的是( )
| A. | 可溶于水 | B. | 含有金属元素 | C. | 水溶液可导电 | D. | 熔融状态能导电 |
12.有乙醛蒸气与乙炔的混合气体aL,当其充分燃烧时,消耗相同状况下O2的体积为( )
| A. | 2aL | B. | 2.5aL | ||
| C. | 3aL | D. | 条件不足无法计算 |
2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则下列有关说法中不正确的是( )
| A. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键,是离子化合物 | |
| C. | NH5的熔沸点高于NH3 | |
| D. | NH5固体投入少量水中,可产生两种气体 |
9.下列递变规律正确的是( )
| A. | 原子半径:O<S<Na | |
| B. | 碱性强弱:LiOH>KOH>CsOH | |
| C. | 还原性:HCl>HBr>HI | |
| D. | 热稳定性:H2O<NH3<SiH4的依次增强 |
6.已知:CH4+Br2$\stackrel{光}{→}$CH3Br+HBr;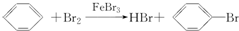
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )
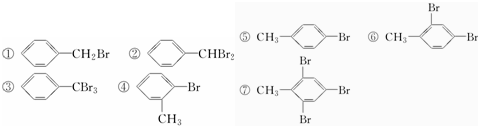
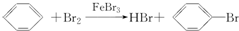
将甲苯与液溴混合,加入铁粉,其反应产物可能有( )

| A. | 只有①②③ | B. | 只有④⑤⑥⑦ | C. | 只有①⑤ | D. | ①②③④⑤⑥⑦ |
7.向100mL 18mol/L H2SO4溶液中加入足量的铜片并加热.充分反应后,则的参加反应H2SO4的物质的量( )
| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |