题目内容
2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层结构,则下列有关说法中不正确的是( )| A. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键,是离子化合物 | |
| C. | NH5的熔沸点高于NH3 | |
| D. | NH5固体投入少量水中,可产生两种气体 |
分析 NH5所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,即氮原子最外层达到8电子稳定结构,所有氢原子达到2电子稳定结构,铵根中的氮原子与四个氢原子形成四个共价键,符合稀有气体原子的最外层结构,剩余的一个氢原子只能是H-,这样才符合2电子的稳定结构,所以是铵根离子和氢阴离子形成的离子化合物,化学式为NH4H.H-具有还原性,H2O具有氧化性,可与水反应生成氨气和氢气.
解答 解:A.NH5为离子混合物,化学式为NH4H,1molNH5中含有4NA个N-H键,故A错误;
B.NH5为离子混合物,分子中存在NH4+和H-,为离子化合物,含有离子键,N-H键为共价键,故B正确;
C.NH5为离子晶体的熔沸点高于分子晶体,故C正确;
D.它与H2O反应,H-具有还原性,H2O具有氧化性,可生成氨气和氢气,反应的方程式为NH5+H2O═NH3•H2O+H2↑,NH3•H2O分解得到氨气,故D正确.
故选A.
点评 本题考查离子化合物的组成和性质,题目难度不大,注意根据题给信息判断化合物的类型.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 含4 mol HCl 的浓盐酸跟足量MnO2加热反应可制得 Cl2的分子数为NA | |
| B. | 将标准状况下 22.4LNO与11.2LO2混合后的体积约为 22.4L | |
| C. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| D. | 1molC(金刚石)中含有C-C键的数目为4NA |
17.某元素的原子核外有三个电子层,其中M电子数是L层电子数的一半,则此元素( )
| A. | C | B. | Si | C. | S | D. | C1 |
7.对于H、D、T、H+四种符号的意义的下列描述正确的是( )
| A. | 表示同一种原子 | B. | 表示不同的原子 | ||
| C. | 表示同一种元素 | D. | 表示氢元素的4种同位素 |
14.下列条件下的反应,放出H2最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Mg | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Mg | 0.1 | 3mol/L HNO3 | 10 | 30℃ |
| A. | A | B. | B | C. | C | D. | D |
12.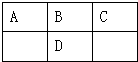 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )| A. | H2CO3 | B. | H2SO4 | C. | HNO3 | D. | H3PO |

 (或写成
(或写成 R代表取代基或氢)
R代表取代基或氢) .
. .
.
 .
.