题目内容
7.向100mL 18mol/L H2SO4溶液中加入足量的铜片并加热.充分反应后,则的参加反应H2SO4的物质的量( )| A. | 小于1.8mol | B. | 等于0.9mol | C. | 等于1.8mol | D. | 大于1.8mol |
分析 根据浓硫酸与铜反应,随着反应的进行,浓硫酸变稀,稀硫酸与铜不反应,浓硫酸与铜反应时被还原的H2SO4为参加反应的浓硫酸的一半.
解答 解:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,被还原的硫酸的物质的量理论上应是参加反应的硫酸的一半,但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半,
则100mL 18mol/LH2SO4溶液中加入足量的铜片并加热后被还原的硫酸的物质的量应为:小于0.9mol,所以参加反应H2SO4的物质的量小于1.8mol;故选A.
点评 本题考查浓硫酸的强氧化性,学生要注意量变会引起质变,同样的物质由于浓度不同,反应就不同.

练习册系列答案
相关题目
17.某元素的原子核外有三个电子层,其中M电子数是L层电子数的一半,则此元素( )
| A. | C | B. | Si | C. | S | D. | C1 |
18.以下反应属于吸热反应的是( )
| A. | 生石灰加水制熟石灰 | B. | 化石燃料的燃烧 | ||
| C. | 氢氧化钠溶液中滴加稀盐酸 | D. | 二氧化碳与高温的炭 |
12.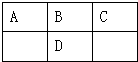 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
 如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )
如图是元素周期表的一部分,A、B、C、D的质子数之和等于32,则它们的最高价氧化物对应水化物酸性最强的是( )| A. | H2CO3 | B. | H2SO4 | C. | HNO3 | D. | H3PO |
19.已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族.A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子.下列说法正确的是( )
| A. | D元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:B>D>E | |
| C. | B、C两种元素的气态氢化物中,C的气态氢化物较稳定 | |
| D. | A与B形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
16. 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 原子半径:己>辛>戊 | |
| B. | 辛是金属元素,元素符号为Ge | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物. |

 .
.
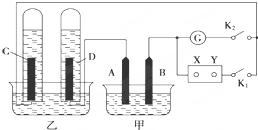 在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.
在图均用石墨作电极的电解池中,甲装置中为500mL含某一溶质的蓝色溶液,乙装置中为500mL稀硫酸.闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g.